
| A. | ②③④⑥ | B. | ①③④⑤ | C. | ②③⑤ | D. | ①②⑥ |
分析 ①盐酸完全电离,氯化铵中存在水解平衡,反应过程中氯化铵溶液中的氢离子的物质的量增大;
②由于碳酸为弱酸,甲酸能够与碳酸钙反应生成二氧化碳,只能证明甲酸的酸性大于碳酸,无法判断甲酸为弱电解质;
③溶液中的导电能力与离子浓度大小有关,与强弱电解质没有必然关系;
④碳酸氢钠电离出钠离子和碳酸氢根离子,碳酸氢根离子不能拆开;
⑤室温下,某溶液中由水电离出的c(H+)=10-a mol/L>10-7 mol/L,促进水电离,说明溶液中的溶质为含有弱离子的盐;
⑥氯化氢为强电解质,醋酸为弱电解质,稀释后盐酸的pH=5,而醋酸的电离程度增大,溶液中氢离子的物质的量增大,所以其pH<5.
解答 解:①NH4Cl溶液水解产生氢离子,盐酸完全电离产生氢离子,体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,因水解平衡正向移动,氯化铵中氢离子的浓度大于盐酸中氢离子的浓度,则氯化铵比Zn反应快,用时少,故①正确;
②甲酸与碳酸钙反应放出CO2,说明甲酸的酸性大于碳酸,由于碳酸为弱酸,则不能说明甲酸是弱电解质,故②正确;
③溶液的导电能力与溶液中离子浓度大小有关,所以在溶液中导电能力强的电解质不一定为强电解质,导电能力弱的电解质也不一定而为弱电解质,如硫酸钡为弱电解质,在溶液中硫酸钡的导电性较差,醋酸为弱酸,醋酸在溶液中导电性大于硫酸钡,故③错误;
④NaHCO3为强电解质,在溶液中完全电离出钠离子和碳酸氢根离子,正确的电离方程式为:NaHCO3=Na++HCO3-,故④错误;
⑤室温下,某溶液中由水电离出的c(H+)=10-a mol/L>10-7 mol/L,促进水电离,说明溶液中的溶质为含有弱离子的盐,溶液的pH为a或14-a,故⑤错误;
⑥pH相等的醋酸和盐酸溶液中,醋酸部分电离,氯化氢完全电离,稀释相同的倍数,醋酸电离程度增大,醋酸中氢离子物质的量增大,盐酸中氢离子物质的量不变,则稀释后醋酸氢离子浓度大于盐酸,盐酸中pH变为5,醋酸中pH小于5,故⑥正确;
根据分析可知,正确的为①②⑥,
故选D.
点评 本题考查了弱电解质的电离及其影响、盐的水解原理、强弱电解质与溶液导电性关系等知识,题目难度中等,试题知识点较多,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握影响弱电解质的电离、盐的水解元素.


科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀氢氧化钠溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 蔗糖 | 饱和硫酸铵溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I- | |
| C. | NaHSO4溶液中滴加过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 醋与氨水混合:CH3COOH+NH3?H2O=CH3COONH4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+c(C2O42-) | |
| B. | NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- | |
| C. | (NH4)2C2O4溶液中:c(NH4+)=2 c(H2C2O4)+2 c(HC2O4-)+2 c(C2O42-) | |
| D. | 草酸使酸性KMnO4溶液褪色,离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
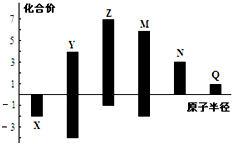 X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )
X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( )| A. | 金属性:N>Q | |
| B. | 最高价氧化物对应水化物酸性:M>Y>N | |
| C. | 简单离子半径:Q>N>X | |
| D. | 原子序数:Z>M>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  所示装置可制备氨气 | |
| B. |  所示装置可分离CH3CH2OH和CH3COOC2H5的混合液 | |
| C. |  所示装置可制备、收集乙烯并验证其易被氧化 | |
| D. |  所示装置可制取乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com