
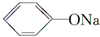
 +CH3I→
+CH3I→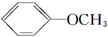 +NaI
+NaI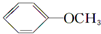 +HI→
+HI→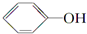 +CH3l
+CH3l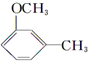 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$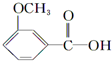
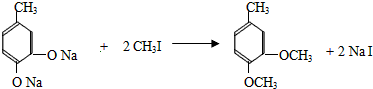 .
. .
. 分析 A的蒸气密度为相同状况下氢气密度的77倍,则A的相对原子质量为154,有机物A中氧的质量分数约为41.6%,则A中O原子个数=$\frac{154×41.6%}{16}$=4,C、H的相对原子质量之和为90,
①A可与NaHCO3溶液作用,产生无色气体,说明A中含有羧基;
②1 molA与足量金属钠反应生成H2 33.6L(标准状况),生成1.5mol氢气,说明该反应中还含有2个羟基;
③A可与FeCl3溶液发生显色反应,说明含有酚羟基;
④A分子苯环上有三个取代基,其中相同的取代基相邻,不同的取代基不相邻,
A中含有苯环、羧基,则C原子个数最少7个,C、H原子的相对原子质量之和为90,则H原子个数为6,
则A的分子式为C7H6O4,A中含有苯环、羧基和两个酚羟基,根据④知,A的结构简式为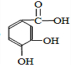 ;
;
E和HI反应生成 ,根据题给信息知,E的结构简式为
,根据题给信息知,E的结构简式为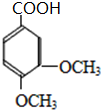 ,D被酸性高锰酸钾溶液氧化生成E,则D的结构简式为
,D被酸性高锰酸钾溶液氧化生成E,则D的结构简式为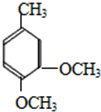 ,C和碘烷发生取代反应生成D,则C的结构简式为
,C和碘烷发生取代反应生成D,则C的结构简式为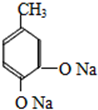 ,B和NaOH溶液反应生成C,有机物B的分子式为C7H8O2,则B的结构简式为
,B和NaOH溶液反应生成C,有机物B的分子式为C7H8O2,则B的结构简式为 ,据此分析解答.
,据此分析解答.
解答 解:A的蒸气密度为相同状况下氢气密度的77倍,则A的相对原子质量为154,有机物A中氧的质量分数约为41.6%,则A中O原子个数=$\frac{154×41.6%}{16}$=4,C、H的相对原子质量之和为90,
①A可与NaHCO3溶液作用,产生无色气体,说明A中含有羧基;
②1 molA与足量金属钠反应生成H2 33.6L(标准状况),生成1.5mol氢气,说明该反应中还含有2个羟基;
③A可与FeCl3溶液发生显色反应,说明含有酚羟基;
④A分子苯环上有三个取代基,其中相同的取代基相邻,不同的取代基不相邻,
A中含有苯环、羧基,则C原子个数最少7个,C、H原子的相对原子质量之和为90,则H原子个数为6,
则A的分子式为C7H6O4,A中含有苯环、羧基和两个酚羟基,根据④知,A的结构简式为 ;
;
E和HI反应生成 ,根据题给信息知,E的结构简式为
,根据题给信息知,E的结构简式为 ,D被酸性高锰酸钾溶液氧化生成E,则D的结构简式为
,D被酸性高锰酸钾溶液氧化生成E,则D的结构简式为 ,C和碘烷发生取代反应生成D,则C的结构简式为
,C和碘烷发生取代反应生成D,则C的结构简式为 ,B和NaOH溶液反应生成C,有机物B的分子式为C7H8O2,则B的结构简式为
,B和NaOH溶液反应生成C,有机物B的分子式为C7H8O2,则B的结构简式为 ,
,
(1)根据上面的分析可知,A的分子式为C7H6O4,
故答案为:C7H6O4;
(2)①反应Ⅱ的化学方程式是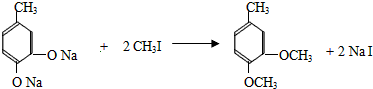 ,
,
故答案为: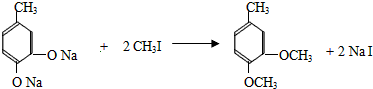 ;
;
②酚羟基不稳定,易被氧化,为防止酚羟基被氧化,所以上述转化中,反应Ⅰ、Ⅱ两步的作用是保护酚羟基,防止其被氧化,
故答案为:保护酚羟基,防止其被氧化;
③B的结构简式为 ,B中含有苯环和酚羟基,所以B可发生的反应有取代反应和加成反应,故选ab;
,B中含有苯环和酚羟基,所以B可发生的反应有取代反应和加成反应,故选ab;
(3)芳香族化合物F与A互为同分异构体,A的结构简式为 ,F可发生银镜反应,说明F含有醛基,1mol F可与含3mol溶质的NaOH溶液作用,其苯环上的一卤代物只有一种,说明F中含有3个酚羟基和一个醛基,则其结构简式为
,F可发生银镜反应,说明F含有醛基,1mol F可与含3mol溶质的NaOH溶液作用,其苯环上的一卤代物只有一种,说明F中含有3个酚羟基和一个醛基,则其结构简式为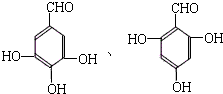 ,共2种,
,共2种,
故答案为:2; .
.
点评 本题考查有机物推断,正确推断A的结构是解本题关键,同时考查学生分析问题、推断能力,明确有机物中官能团即可推断其性质,采用逆向分析方法推断其它物质,注意结合题给信息解答问题,题目难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氢量:苯>乙烯>甲烷 | |
| B. | 密度:H 2O>溴苯>苯 | |
| C. | 沸点:戊烷>2-甲基丁烷>2,2-二甲基丙烷 | |
| D. | 等质量的下列物质燃烧耗O 2量:乙炔>乙烯>乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 +2H2O.
+2H2O.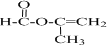 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中有下列平衡:Br2+H2O?HBr+HBrO当加入AgNO3(s)后溶液颜色变浅 | |
| B. | 2NO2(g)?N2O4(g)△H<0,升高温度可使体系颜色加深 | |
| C. | 反应N2+3H2?2NH3△H<0,增大压强可提高N2的转化率 | |
| D. | 合成氨反应CO+NO2?CO2+NO△H>0中使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖(C6H12O6)与蔗糖(C12H22O11) | B. | 醋酸与甲酸甲酯(C2H4O2) | ||
| C. | 乙醇与甲醛(CH2O) | D. | 二甲醚(C2H6O)与乳酸(C3H6O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1-△H2 | B. | △H2-△H1 | C. | △H1+△H2 | D. | -(△H1-△H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com