
 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的作用.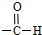 )碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.
)碳原子的杂化方式为sp2;乙醇的沸点明显高于乙醛,其主要原因为乙醇分子间存在氢键.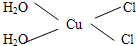 .
.分析 (1)Cu原子核外有29个电子,其基态原子电子排布式为1s22s22p6 3s23p63d104s1,Cu原子失去最外层一个电子生成Cu+,根据构造原理书写Cu+核外电子排布式;同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(2)与N3-含有相同电子数的四原子分子为NH3,根据价层电子对互斥理论确定其空间构型;
(3)乙醛分子中醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式;乙醇分子间可形成氢键导致沸点较高;
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称;
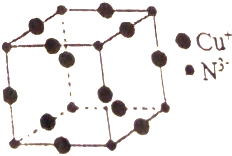
(5)Cu3N的晶胞结构如图,大球个数=12×$\frac{1}{4}$=3,小球个数=8×$\frac{1}{8}$=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数为6,根据ρ=$\frac{m}{V}$计算密度.
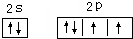
解答 解:(1)Cu原子核外有29个电子,其基态原子电子排布式为1s22s22p6 3s23p63d104s1,Cu原子失去最外层一个电子生成Cu+,根据构造原理知Cu+核外电子排布式为1s22s22p6 3s23p63d10;同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能大小顺序是N>O;
故答案为:1s22s22p63s23p63d10;>;
(2)与N3-含有相同电子数的四原子分子为NH3,NH3分子中N原子的价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,且含有一个孤电子对,中心原子采用sp3杂化,所以为三角锥型结构;
故答案为:三角锥型;
(3)乙醛分子中醛基上的碳原子含有3个σ键,所以醛基中碳原子采用sp2杂化;乙醇分子间可形成氢键,增加了分子之间的作用,乙醛不能形成氢键,所以乙醇的沸点高于乙醛,
故答案为:sp2;乙醇分子间存在氢键;
(4)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,[Cu(H2O)2(Cl)2]具有极性的分子,说明该分子的结构不对称,则其结构式为: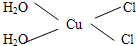 ,
,
故答案为: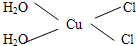 ;
;
(5)Cu3N的晶胞结构如图,大球个数=12×$\frac{1}{4}$=3,小球个数=8×$\frac{1}{8}$=1,所以大球表示Cu原子、小球表示N原子,N3-的配位数为6,该晶胞棱长=(a+b)pm=(2a+2b)×10-10cm,晶胞体积=(a×10-7)3cm3,晶胞密度ρ=$\frac{m}{V}$=$\frac{\frac{206}{N{\;}_{A}}}{(a×10{\;}^{-7}){\;}^{3}}$g•cm-3=$\frac{206}{{N}_{A}(a×1{0}^{-7})^{3}}$g•cm-3;
故答案为:6;$\frac{206}{{N}_{A}(a×1{0}^{-7})^{3}}$;
点评 本题考查晶胞计算、微粒空间构型判断、原子杂化方式判断、原子核外电子排布等知识点,侧重考查分析、计算、空间想象能力,明确均摊法、价层电子对互斥理论、构造原理等知识点即可解答,难点是晶胞计算方法,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y、Z的简单离子具有相同的电子层结构 | |
| B. | W的简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Z两种元素组成的化合物中阴阳离子个数比一定为1:2 | |
| D. | 离子半径:r(Z)<r(Y)<r(X)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol/L | B. | 0.5 mol/L | C. | 0.1 mol/L | D. | 0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; (用元素符号表示).
(用元素符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3是医用的胃酸中和剂的一种 | |
| B. | 铁的氧化物都不溶于水,但可与水反应 | |
| C. | 铁容易形成致密的氧化膜,抗腐蚀性能好 | |
| D. | 取一片铝条放在酒精灯上加热至熔化,铝会滴落下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 CO+3H2.
CO+3H2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com