
| A.只有Fe2+ | B.只有Fe3+ |
| C.有Fe2+和Cu2+ | D.有Fe3+和Cu2+ |
科目:高中化学 来源:不详 题型:实验题
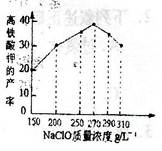

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

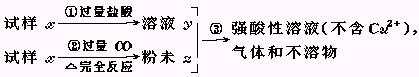
 (1)请写出步骤③中所发生的全部反应的离子方程式.
(1)请写出步骤③中所发生的全部反应的离子方程式. (2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).
(2)若全部的溶液y和全部的粉末Z充分反应后,生成的不溶物的质量是m,则每份试样x中氧化铜的质量为 (用m表示).查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3 | B.反应后所得溶液中的Fe2+和Cl–的物质的量之比为1:3 | C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多 | D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色 Fe(OH)3.这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+. |
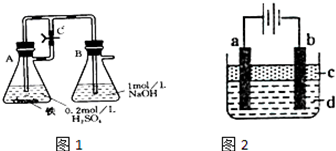
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
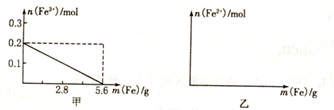
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com