
 2NO2��Ӧ��ƽ��ʱNO��ת�������¶ȱ仯��ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
2NO2��Ӧ��ƽ��ʱNO��ת�������¶ȱ仯��ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����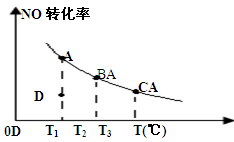
| A���÷�Ӧ������Ӧ�����ȷ�Ӧ |
| B�����¶�ΪT1��T3ʱ��ƽ�ⳣ���ֱ�ΪK1��K3����K1��K3 |
| C��T1ʱ������Ӧ����D�㣬��÷�Ӧ���淴Ӧ���ʴ�������Ӧ���� |
| D�������С�����������ƽ��ʱ��ʾNOת�������¶ȱ仯��ϵ��������ԭ�����Ϸ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 aZ(g) ��H=QkJ��mol-1����ʼ�������2:1��X��Y���뷴Ӧ���У�һ�������·�����Ӧ��ͼ��ͼ���Ǹ��ݷ�Ӧ���Ƶ�ͼ�������й�˵����ȷ����
aZ(g) ��H=QkJ��mol-1����ʼ�������2:1��X��Y���뷴Ӧ���У�һ�������·�����Ӧ��ͼ��ͼ���Ǹ��ݷ�Ӧ���Ƶ�ͼ�������й�˵����ȷ����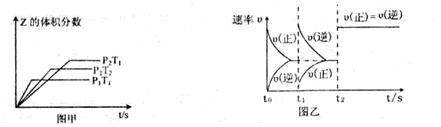
| A��ͼ�ף�P1��P2��a �� 3 |
| B��ͼ�ף�T1��T2��Q��0 |
| C��ͼ�ң�t1ʱ��ʾ���¡���ѹ�����£���ƽ����ϵ�г���һ������Z���� |
| D��ͼ�ң����a=3, t2ʱ��ʾ����ϵ�м����˴��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g) ��H<0��2 min��Ӧ�ﵽƽ�⣬����CΪ1��6 mol�������з�����ȷ���� �� ��
2C(g) ��H<0��2 min��Ӧ�ﵽƽ�⣬����CΪ1��6 mol�������з�����ȷ���� �� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
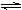 NH3(g) + HI(g)
NH3(g) + HI(g)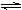 H2(g) + I2(g)
H2(g) + I2(g)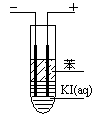
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ�� �� �����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ ��(Li�����ԭ������ԼΪ7.0)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��
2NH3(g) ��H=��94.4kJ��mol��1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ��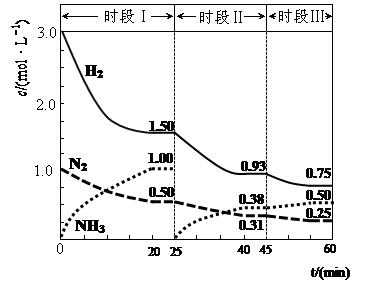
 5N2(g)+6H2O(g) ��H<0������Ӧ�ڣ�2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ��H<0������Ӧ�ڣ�2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
5N2O(g)+3H2O(g) ��H��0��ƽ��������N2��N2O�������¶ȵĹ�ϵ����ͼ����ش���400K��600Kʱ��ƽ��������N2�������¶ȵı仯������ ���������ֹ��ɵ�ԭ���� ���δ������һ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ���ǣ���������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol/��L��s������������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol/��L��s�����۷�Ӧ�ﵽƽ��ʱ��A��B��C�ķ�Ӧ����һ����ȣ��ܷ�Ӧ�ﵽƽ��ʱ��A��B��C�����ʵ��������ٱ仯
2C��g������2 s ����C��Ũ��Ϊ0.6 mol/L�����м���˵����ȷ���ǣ���������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol/��L��s������������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol/��L��s�����۷�Ӧ�ﵽƽ��ʱ��A��B��C�ķ�Ӧ����һ����ȣ��ܷ�Ӧ�ﵽƽ��ʱ��A��B��C�����ʵ��������ٱ仯�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
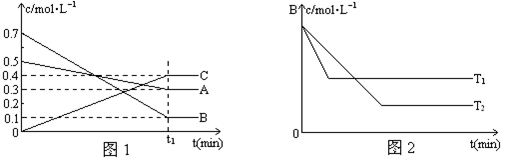
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)+2D(g) ��H��0����ͼ������a��b�ֱ��ʾ�ڲ�ͬ�����£�A��B��Ӧʱ��D�����������ʱ��t�ı仯���������ʹ����b(ʵ�ߣ���Ϊ����a(���ߣ����ɲ��õĴ�
2C(g)+2D(g) ��H��0����ͼ������a��b�ֱ��ʾ�ڲ�ͬ�����£�A��B��Ӧʱ��D�����������ʱ��t�ı仯���������ʹ����b(ʵ�ߣ���Ϊ����a(���ߣ����ɲ��õĴ�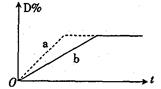
| A���٢ڢ� | B���ܢ� | C���ۢܢ� | D���ܢݢ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com