
【题目】第四届中国工业大奖于2016年12月11日在北京颁奖,获奖项目之一为国家级一类抗癌新药——盐酸埃克替尼的研发。它的关键中间体G的一种合成路线如下:

己知:①A分子中只有一种化学环境的氢;
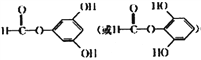
②TsCl为![]() 。
。
(1)A的名称为______________。
(2)G中所含官能团的名称是______________; E的结构简式为___________________。
(3)由B生成C的反应类型是_____________,由F生成G的反应类型是______________。
(4)PEO是由A在烃基铝催化下加聚而成的线型髙分子,该加聚反应的化学方程式为_______________。
(5)三取代芳香族化合物W是D的同分异构体。W既能发生银镜反应和水解反应,又能与FeCl3溶液发生显色反应。1molW最多可与4molNaOH反应,W的核磁共振氢谱只有4组峰。W的结构简式为_________________。
(6)参照上述合成路线, 以邻硝基甲苯( )和乙醇为原料(无机试剂任选),设计制备邻氨基苯甲酸乙酯(
)和乙醇为原料(无机试剂任选),设计制备邻氨基苯甲酸乙酯(![]() )的合成路线。_________________
)的合成路线。_________________
【答案】 环氧乙烷 醛键、羧基、氨基  取代反应 还原反应
取代反应 还原反应 ![]()
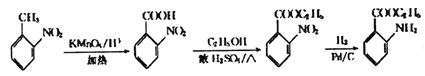
【解析】(1)A分子中只有一种化学环境的氢,则A为![]() ,是环氧乙烷,故答案为:环氧乙烷;
,是环氧乙烷,故答案为:环氧乙烷;
(2)G为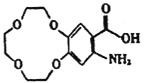 ,所含官能团有醛键、羧基、氨基;根据流程图,E发生硝化反应生成F(
,所含官能团有醛键、羧基、氨基;根据流程图,E发生硝化反应生成F(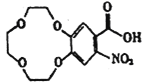 ),则E为
),则E为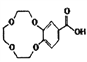 ,故答案为:醛键、羧基、氨基;
,故答案为:醛键、羧基、氨基; ;
;
(3)根据BC的结构差别,由B生成C的反应类型是取代反应;根据流程图,由F生成G的反应是硝基的还原反应,故答案为:取代反应;还原反应;
(4)PEO是由A在烃基铝催化下加聚而成的线型髙分子,该加聚反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)D为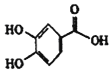 ,三取代芳香族化合物W是D的同分异构体。W既能发生银镜反应和水解反应,说明W中含有酯基和醛基,又能与FeCl3溶液发生显色反应,说明含有酚羟基。1molW最多可与4molNaOH反应,因此,W属于甲酸苯酚酯,且含有2个酚羟基,W的核磁共振氢谱只有4组峰,则W的结构简式为
,三取代芳香族化合物W是D的同分异构体。W既能发生银镜反应和水解反应,说明W中含有酯基和醛基,又能与FeCl3溶液发生显色反应,说明含有酚羟基。1molW最多可与4molNaOH反应,因此,W属于甲酸苯酚酯,且含有2个酚羟基,W的核磁共振氢谱只有4组峰,则W的结构简式为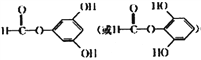 ,故答案为:
,故答案为: ;
;
(6)以邻硝基甲苯(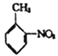 )和乙醇为原料制备邻氨基苯甲酸乙酯(
)和乙醇为原料制备邻氨基苯甲酸乙酯(![]() ),可以首先将
),可以首先将 的甲基氧化为羧基,再与乙醇酯化,最后将硝基还原即可,合成路线为
的甲基氧化为羧基,再与乙醇酯化,最后将硝基还原即可,合成路线为 ,故答案为:
,故答案为: 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验).

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化,继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是 .
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2.
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是 .
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是 .
③iii中滴入少量H2O2没有明显变化.提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是 .
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是有关厨房中的常见操作或常见现象,其中不属于氧化还原反应的是( )
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用气灶燃烧沼气(主要成分为甲烷)为炒菜提供热量
C.牛奶久置变质腐败
D.氧化铜固体加入稀盐酸中,完全溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、A1,少量Cr、FeS等)来制备,其工艺流程如下:

回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为________________。
(2)“溶解”时放出的气体为_________(填化学式)。
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+,其离子方程式为______________。
(4)己知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr3+ | 4.5 | 5.6 |
“调pH 1”时,溶液pH范围为__________;过滤2所得滤渣的成分为___________(填化学式)。
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式______________。
(6)若加热不充分,则制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·y Ni(OH)2。现称取8.29g xNiOOH·y Ni(OH)2样品溶于稀硫酸,搅拌至溶液澄清,定容至200mL,从中移取20.00 mL,用0.010mol·L-1的KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4 标准溶液 20.00 mL。已知 5Ni2++MnO4-+8H+=5Ni3++Mn2++4H2O,则x=_________,y=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃若溶液中由水电离产生的C(OH-)=1×10-14 mol·L-1,满足此条件的溶液是()
A. 酸性 B. 碱性 C. 酸性或碱性 D. 中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离混合物的操作中正确的是( )
A.用分液的方法分离水和四氯化碳
B.用分液的方法分离植物油和汽油
C.用过滤的方法分离酒精和水
D.用过滤的方法分离四氯化碳和碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
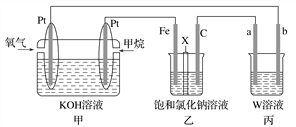
(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不正确的是
A. 用量筒量取25 mL蒸馏水 B. 用分液漏斗分离乙醇和水
C. 用烧杯溶解FeCl3试样 D. 用托盘天平称量NaCl固体5.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
A. 2.24LCO2中含有的原子数为0.3 ×6.02×1023
B. 0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C. 5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D. 4.5 SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com