
向含1mol HCl和1mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,产生沉淀的物质的量与加入Ba(OH)2溶液体积间的关系图正确的是( )
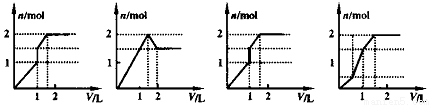
 A B C D
A B C D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年河北省高一上11月月考化学卷(解析版) 题型:填空题
(1)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2_______________________;②NaHSO4____________。
(2)按要求写出下列反应的离子方程式
A.向①中加足量醋酸___________________
B.向②中加锌粉___________________
C.①②水溶液混合后恰好沉淀完全时___________________
(3)砷及其化合物有毒,如砒霜(As 2O 3)有剧毒,环境监测和法医学分析砒霜中毒的反应原理:
As2O3+6Zn+12HCl=6ZnCl2+2AsH3↑+3H2O,
①反应中被还原的元素是 (用化学式回答),若参加反应Zn的质量为19.5g,则生成的气体在标准状况下的体积为
②用双线桥法标出上述反应中电子转移的方向和数目。
查看答案和解析>>
科目:高中化学 来源:2017届山西省晋商四校高三上11月联考化学试卷(解析版) 题型:选择题
下列实验中,所选取的分离装置与对应原理都正确的是( )

选项 | 目的 | 装置 | 原理 |
A | 氢氧化铁胶体的纯化 | ① | 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸 |
B | 分离苯中的溴苯 | ③ | 苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同 |
C | 粗盐提纯 | ② | NaCl在水中的溶解度很大 |
D | 除去环己醇中的环己烯 | ④ | 环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上月考三化学卷(解析版) 题型:选择题
在某密闭容器中,可逆反应:A(g) + B(g) xC(g)符合图中(Ⅰ)所示关系:
xC(g)符合图中(Ⅰ)所示关系: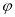 (C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
(C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
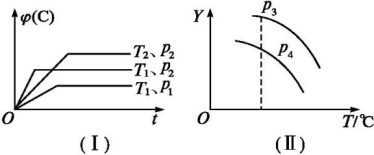
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上月考三化学卷(解析版) 题型:选择题
下列说法正确的是:
A.石蕊试纸和pH试纸使用前都必须用蒸馏水润湿
B.电离和水解反应都是吸热反应
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.酸式盐的pH均小于7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津静海一中等六校高一上期中化学卷(解析版) 题型:选择题
下列实验操作正确且能达到相应实验目的的是( )
| 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 制备Fe(OH)3胶体 | 向沸水中逐滴加入少量氯化铁饱和溶液,继续加热煮沸至液体变为红褐色 |
C | 检验溶液中是否含有SO42- | 取少量试液于试管中,先加入BaCl2溶液,再滴加稀盐酸,若产生的白色沉淀不溶解,则说明溶液中含有SO42- |
D | 萃取碘水中的碘 | 将碘水倒入分液漏斗,然后再注入酒精,振荡,静置分层后,下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津静海一中等六校高一上期中化学卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.1 mol O2作为氧化剂失去的电子数为4NA
B.标准状况下,22.4L CCl4所含的分子数大于NA
C.1mol/L NaCl溶液所含的Cl﹣物质的量NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上期中化学卷(解析版) 题型:填空题
请按要求完成下列各题:
(1)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是__________
(2)将2.3 g 金属钠投入到2.0 mol/L  100 mL的MgCl2溶液中,完全反应后,所得溶液中Mg2+的物质的量浓度为__________(假定反应后溶液体积不变);如果将钠、镁、铝均为0.3 mol分别与100 mL浓度为1 mol/L的HCl溶液反应,产生氢气的体积比为____________。
100 mL的MgCl2溶液中,完全反应后,所得溶液中Mg2+的物质的量浓度为__________(假定反应后溶液体积不变);如果将钠、镁、铝均为0.3 mol分别与100 mL浓度为1 mol/L的HCl溶液反应,产生氢气的体积比为____________。
(3)某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和SO42-的离子个数比为__________。
(4)青铜是人类 历史上的一项伟大发明。工业冶炼铜的原理主要是:
历史上的一项伟大发明。工业冶炼铜的原理主要是:
(Ⅰ)2Cu2S(硫化亚铜)+3O2 2Cu2O+2SO2↑
2Cu2O+2SO2↑
(Ⅱ)2Cu2O(氧化亚铜)+Cu2S 6Cu+SO2↑
6Cu+SO2↑
①用“单线桥法”表示出上述反应(Ⅰ)中电子转移的方向和数目。
2Cu2S(硫化亚铜)+3O2 2Cu2O+2SO2↑
2Cu2O+2SO2↑
②该反应(Ⅰ)中的还原产物是____________;反应(Ⅱ)中被氧化的物质是____________。
③若反应(Ⅰ)和反应(Ⅱ)均转移的电子数为1.806×1024,则在标准状况下产生的二氧化硫的体积为_____________ L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西大学附中高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.自发进行的反应一定是放热反应 B.非自发进行的反应一定是吸热反应
C.自发进行的反应一定能发生 D.有些吸热反应也能自发进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com