
| 10 |
| 12 |
| 5 |
| 6 |
| 10 |
| 12 |
| 5 |
| 6 |


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、PM2.5值越大,形成雾霾天气的可能性越大 | B、火电及北方冬季供暖烧煤所产生的废气是形成雾霾的一个重要因素 | C、氟氯烃作致冷剂会加剧雾霾天气的形成 | D、城市由于汽车尾气的大量排放,比农村形成雾霾的可能性大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
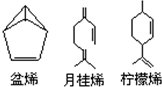 盆烯、月桂烯、柠檬烯等萜类化合物广泛存在于动、植物体内,关于这些有机物的下列说法中正确的是( )
盆烯、月桂烯、柠檬烯等萜类化合物广泛存在于动、植物体内,关于这些有机物的下列说法中正确的是( )| A、①②④ | B、①②③④ | C、①②③ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
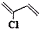 )是制备氯丁橡胶的原料.由于双键上的氢原子很难发生取代反应,因此它不能通过l,3-丁二烯与Cl2直接反应制得.下面是2-氯-1,3-丁二烯的合成路线:
)是制备氯丁橡胶的原料.由于双键上的氢原子很难发生取代反应,因此它不能通过l,3-丁二烯与Cl2直接反应制得.下面是2-氯-1,3-丁二烯的合成路线:
查看答案和解析>>
科目:高中化学 来源: 题型:
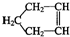 可简写为
可简写为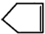 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: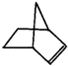
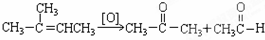
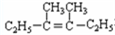 在上述类似条件下发生反应,请写出反应的方程式
在上述类似条件下发生反应,请写出反应的方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物可能含有共价键 | B、常温下的气体分子中一定都含有共价键 | C、共价化合物中可能含有离子键 | D、非极性分子中一定都含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠能与二氧化碳反应,可用作呼吸面具的供氧剂 | B、氧化铝的熔点高,可用于制作耐高温仪器 | C、二氧化硅有导电性,可用于制作光导纤维 | D、石灰石是制水泥和玻璃的主要原料之一 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
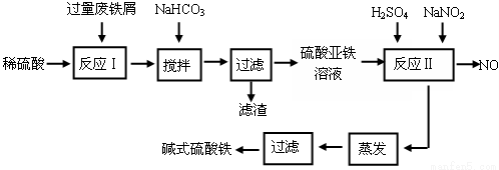
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 ,发生反应的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com