
已知金属钾有如下性质:①钾的密度比水小;②钾的熔点低;③钾与水反应时放出热量;④钾与水反应后溶液呈碱性。某学生将一小块金属钾投入滴有酚酞溶液的水中,以上实验能证明上述四点性质中的( )
A.①④ B.①②④ C.①③④ D.①②③④
科目:高中化学 来源: 题型:
某盐的混合物中含有0.2mol Na+,0.4mol Mg2+,0.4mol Cl-,则SO42-为( )
A.0.1mol B.0.3mol C.0.5mol D. 0.15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
有28gCuO和MgO固体混合物与200ml硫酸恰好完全反应,将反应后的溶液小心蒸干,得到固体68g。则原硫酸溶液的物质的量浓度和原固体混合物中氧元素的质量分数分别是( )
A.2.5mol•L-1 28.57% B. 2.2mol•L-1 23.07%
C. 1.5mol•L-1 24.55% D.2.5mol•L-1 18.37%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| D | 向淀粉水解液中加入新制Cu(OH)2,煮沸 | 没有生成砖红色沉淀 | 淀粉未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) = MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) = Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) = 2Mg(s)+Mg2NiH4(s) 的△H3= ▲ 。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下:
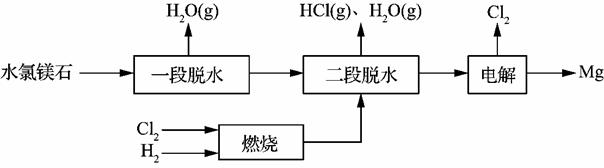
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
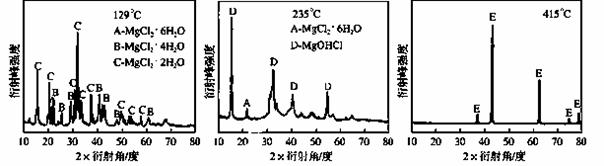
测得E中Mg元素质量分数为60.0%,则E的化学式为 ▲ 。
“一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是 ▲ 。
 ②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 ▲ 。
③该工艺中,可以循环使用的物质有 ▲ 。
(3)储氢材料Mg(AlH4)2在110-200°C的反应为:
Mg(AlH4)2=MgH2 +2A1+3H2↑
每生成27gAl转移电子的物质的量为 ▲ 。
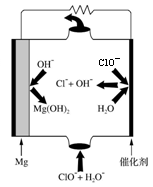
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池的正极反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知HI为无色气体,在一定条件下,对于可逆反应H2(g)+I2(g) 2HI(g),下列叙述中能表明该反应已达到化学平衡状态的是( )
2HI(g),下列叙述中能表明该反应已达到化学平衡状态的是( )
A.HI的生成速率与H2的生成速率相等 B.H2的生成速率与I2的生成速率相等
C.混合物的颜色不再发生变化 D.H2、I2、HI的分子数之比为1∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指一定条件下1 mol可燃物完全燃烧生成稳定的氧化物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)====CO2(g)ΔH = -283.0 kJ·mol-1
②H2(g)+ 1/2O2(g)====H2O(g)ΔH = -241.8 kJ·mol-1
则下列说法正确的是( )
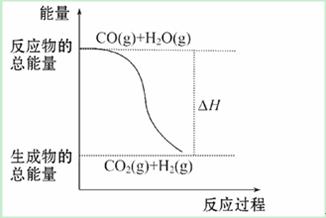
A. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)==== CO2(g)+H2(g)ΔH = -41.2 kJ·mol-1
B. H2的燃烧热为241.8 kJ·mol-1
C.H2(g)转变成H2O(g)的化学反应一定要释放能量
D.根据②推知反应H2(g)+1/2O2(g)==== H2O(l)ΔH > -241.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com