
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离出的c(H+)·c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32-
B.澄清透明溶液:Mg2+、Cu2+、Cl-、SO42-
C.使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3-
D.含0.1mol·L-1 KI的溶液:Fe3+、Na+、NO3-、Cl-
科目:高中化学 来源: 题型:
以天然气、焦炭、水、空气为初始原料,可以制得若干化工产品:

请回答下列问题:
(1)合成氨中原料气体N2来源于空气,可采用将空气________和________两种方法,H2可采用上述反应①,其化学方程式为____________________________________________。
(2)对于合成氨N2+3H2 2NH3 ΔH<0,其中N2与H2体积比高于1∶3的原因是_______________________________;及时分离NH3的方法是_________________________。
2NH3 ΔH<0,其中N2与H2体积比高于1∶3的原因是_______________________________;及时分离NH3的方法是_________________________。
(3)制取NH4NO3时,NH3的用途有两种,制HNO3的量大于与HNO3反应的量的原因________________________________________________________________________。
(4)发生反应⑤的化学方程式为_____________________________________________。
(5)发生反应③生成C8H18的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是:
A.电化学反应不一定是氧化还原反应
B.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
C.2NO+2CO 2CO2+N2 的△H<0,则该反应一定能自发进行
2CO2+N2 的△H<0,则该反应一定能自发进行
D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D ,它们原子的电子层数与最外层电子数之比分别是1∶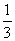 ,1∶1 ,1∶2和1∶3 。
,1∶1 ,1∶2和1∶3 。
据此回答下列问题:
(1)仅根据上述信息就能够确定的元素是 (选填A、B、C、D)。
(2)在所有满足上述信息的短周期元素中,最高价氧化物的水化物酸性最强的是(填化学式) ;由A、D两元素构成的化合物A2D2的电子式为(用元素符号填写,下同) 。
(3)在满足上述信息的短周期元素中,若B2、CD和由B、C、D形成的化合物X的混合物m g ,在一定条件下与过量氧气反应后,将产物通过足量的固体A2D2 ,最终发现固体质量增重为m g ,则符合此条件的X的分子组成可用通式( )x·( )y 来表示。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是[微软用户8]
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O
B.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.向Ca(ClO)2 溶液中通入过量的 SO2:C1O- + SO2 + H2O = HClO + HSO3-
D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2 = 2Fe3++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是[微软用户15]
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是[微软用户15]
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C. 若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ
D. 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水的处理主要包括水的净
化、污水处理、硬水软化和海水的淡化等。
(1)海水的淡化常用的方法有_________、
_________、电渗析法等。
(2)电渗析法是近年来发展起来的一种较好
 的海水淡化技术,其原理如图所示。
的海水淡化技术,其原理如图所示。
①阳极(惰性电极)的电极反应式为 __________________.
②淡水的出口为a、b、c中的_________ 出口。
③某出口排出的浓海水中溴元素的含量为0.68g/L,现用氯气将其中的溴离子
氧化为溴单质,则处理l.Ox10 L该浓海水需标况下的氯气的体积为_________
L该浓海水需标况下的氯气的体积为_________ 。
。
(3) K2FeO4是自来水厂常用的消毒、净化剂。工业上常用Fe(NO3)3溶液与浓KCIO溶液在强碱性环境中生成K2FeO4,该反应的离子方程式为___________________________.
(4)氯碱工业常用_________(填“阴”或“阳”)离子交换膜电解槽电解精制的饱和食盐水, 若食盐水中含有杂质MgCl2则会对离子交换膜电解槽造成损害,其原因是_______ (用离子方程式表示)。
(5)工程塑料ABS合成时,用了以下三种单体: 、
、
 ,请写出ABS的结构简式_______________________________。
,请写出ABS的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,一定量的A和B气体发生如下可逆反应: A(g)+3B(g) 3C(g),只有反应到达平衡时才具有的性质是 ( )
3C(g),只有反应到达平衡时才具有的性质是 ( )
A. 各物质的浓度之比为1:3:3 B.反应后混合物中各物质的量浓度相等
C. A、B、C三种物质的浓度不随时间变化而变化 D. ν(A)、ν(B)、ν(C) 之比为1:3:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com