
元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
| A.所有元素原子的最外层电子数都等于元素的最高化合价 |
| B.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| C.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
科目:高中化学 来源: 题型:单选题
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y: 154pm Z:125pm W: 117pm,X Y W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是
| | | | | X |
| Y | | | W | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W、R五种元素,原子序数依次增大,且原子序数都小于20,X元素的原子是所有元素的原子中半径最小的,Y、W同主族,Z、W同周期,Y元素原子的最外层电子数是次外层的3倍,Z、R分别是同周期中金属性最强的元素。下列说法不正确的是( )
| A.沸点:X2Y>X2W |
| B.由X、Y、Z、W四种元素组成的化合物既含有共价键又含离子键 |
| C.原子半径:X<Y<Z<W<R |
| D.Y与W形成的化合物WY2是形成酸雨的主要物质之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z分别是短周期元素的三种单质,它们都是常见的金属或非金属。M、N、R是常见的三种氧化物。其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):
(1)X+Z→N;
(2)M+X→N;
(3)M+Y→R+X。
若X是非金属,则组成Y单质的元素在周期表中的位置是( )
| A.第二周期ⅣA族 | B.第二周期ⅥA族 |
| C.第三周期ⅡA族 | D.第三周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )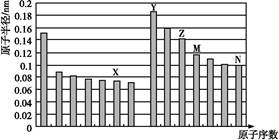
| A.N、Z两种元素的离子半径相比前者较大 |
| B.M、N两种元素的气态氢化物的稳定性相比后者较强 |
| C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应 |
| D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列判断中一定正确的是( )
| A.若A2+2D-=2A-+D2,则还原性:D->A- |
| B.若R2+和M+的电子层结构相同,则碱性:ROH>MOH |
| C.若X2、Y2都是气态单质,且酸性HX>HY,则非金属性X>Y |
| D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同位素2H、15N、18O、34S等常被用作陆地生态分析研究。下列说法中正确的是( )
| A.16O和18O是同一种核素 |
| B.1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 |
| D.2H+核外电子数为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W为四种短周期元素,它们在周期表中位于连续的四个主族,如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
( )。
| A.Y元素最高价氧化物对应的水化物化学式为H3YO4 |
| B.Y最简单气态氢化物的水溶液显弱碱性 |
| C.原子半径由小到大的顺序为:X<Z<Y<W |
| D.X、Z两种元素的氧化物中所含化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则 ( )。
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com