
【题目】某化合物的结构式(键线式)及球棍模型如下,该有机分子的1H核磁共振谱图如下(单位是ppm)。下列关于该有机物的叙述正确的是

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在一定条件下能够发生消去反应
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
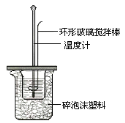
(1)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏 大、偏小、无影响”)
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由__
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种检测空气中甲醛(HCHO)含量的电化学传感器的工作原理如图所示。下列说法正确的是

A. 传感器工作时,工作电极电势高
B. 工作时,H+通过交换膜向工作电极附近移动
C. 当导线中通过1.2×l0-6 mol电子,进入传感器的甲醛为3×10-3 mg
D. 工作时,对电极区电解质溶液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )

A. 0.5% B. 1.0% C. 0.1% D. 1.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)装置A是CO2气体的发生装置,请写出仪器a的名称__________。
(2)B中盛饱和NaHCO3溶液,其作用是___________。
(3)写出C中过氧化钠与二氧化碳反应的化学方程式____________________。
(4)D中盛放的试剂可以是__________(填序号)。
① 浓H2SO4 ② NaOH溶液 ③ CaCl2溶液 ④ Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷诺嗪是治疗慢性心绞痛首选新药。雷诺嗪合成路线如下:

(1)雷诺嗪中含氧官能团,除酰胺键(-NHCO-)外,另两种官能团名称:___、____。
(2)写出满足下列条件A的同分异构体的数目_____。①能与FeCl3溶液发生显色反应;②1mol该分子可与2molNaOH反应。
(3)从雷诺嗪合成路线得到启示,可用间二甲苯、ClCH2COCl、(C2H5)NH(无机试剂任用)合成盐酸利多卡因,请在横线上补充反应物,在方框内补充生成物。_____、_____、_____、_____、_____、_____。

盐酸利多卡因
已知:![]()

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S![]() H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)

(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“![]() ”、“
”、“![]() ”、“
”、“![]() ”
”
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com