
A、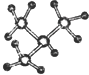 和 和 互为同系物 互为同系物 |
| B、用系统命名法命名新戊烷为2,2-二甲基丙烷 |
| C、相对分子质量相近的醇和烷烃相比,醇的沸点远远低于烷烃 |
| D、石油化工中的分馏、裂化、裂解都是通过化学变化得到轻质油 |


科目:高中化学 来源: 题型:
| A、超临界水的pH较常温时升高 |
| B、超临界水的离子积增大 |
| C、超临界水发生了化学变化 |
| D、大多数有机物在超临界水中溶解度更小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室蒸馏石油时,冷凝管水流方向应从上到下与蒸汽流动方向相同 |
| B、蒸发结晶时不必将溶液加热到蒸干 |
| C、萃取操作必须在分液漏斗中进行 |
| D、用剩的药品应收集起来放回指定的回收处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y |
| Z | W |
| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径小 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、W的气态氢化物的稳定性一定比Y的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
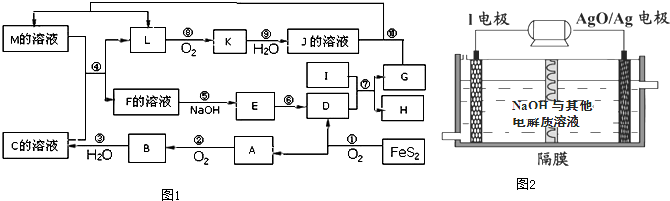
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成了一种强酸弱碱盐 |
| B、等浓度的强酸和弱碱溶液反应 |
| C、浓的弱酸溶液和稀的强碱溶液反应 |
| D、浓的强酸和稀的强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
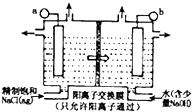 ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com