
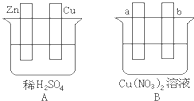
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。

(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
Ⅰ.(1)a,b (2)2H+ + 2e- = H2↑(3)电解池,b(或阳)
(4)降低,CuO b极材料为Cu
Ⅱ.铁锅是生铁制造的,生铁中的Fe、C和炒菜未洗净的食盐水构成原电池(1分),使铁发生电化学腐蚀生成Fe(OH)2, Fe(OH)2再被氧化成Fe(OH)3,Fe(OH)3部分失水得到铁锈。负极:2Fe - 4e- = 2Fe2+;正极:O2 + 2H2O +4e- = 4OH-;
4Fe(OH) +O2 +2H2O = 4Fe(OH)3
【解析】
试题分析:I.A可形成原电池,Zn作负极,Cu作正极,使a极析出铜,a极为阴极,所以a与Zn连接,b与Cu连接。A中Cu极发生的反应为2H++2e-=H2↑、Zn极发生的反应为Zn-2e-=Zn2+。B装置叫电解池,溶液中NO3-向阳极移动。电解硝酸铜溶液生成铜、硝酸和氧气,溶液酸性增强,pH减小,阳极析出氧气、阴极析出铜,加入氧化铜能使溶液浓度恢复到反应前浓度,若反应一段时间后Cu2+浓度没有明显下降,说明阳极溶解Cu生成Cu2+。II.铁生锈的机理是铁、炭、食盐水形成原电池,Fe为负极,Fe-2e-=Fe2+。炭为正极,电极反应为O2+2H2O+4e-=4OH-,总反应为2Fe+O2+2H2O=2Fe(OH)2,Fe(OH)2被氧化为Fe(OH)3、Fe(OH)3失水生成Fe2O3·xH2O。
考点:电化学
点评:钢铁电化腐蚀分两种:吸氧腐蚀和析氢腐蚀,当电解质溶液酸性较强时,发生析氢腐蚀;当电解质溶液呈中性或碱性时发生吸氧腐蚀,


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜.回答有关问题.查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省执信中学高二上学期期末考试理科化学试卷(带解析) 题型:填空题
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。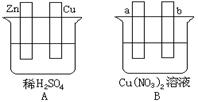
(1)导线将容器A和B连接时,Zn接 ,Cu接 (填“a”或“b”)
(2)容器A中Cu极发生的电极反应为 。
(3)B装置叫 ,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将 (填“升高”、“降低”或“不变”),加入一定量的 后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是: 。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省广州市执信中学高二(上)期末化学试卷(理)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com