
| A.Mg2+、Na+、Cl-、SO42- | B.K+、 Na+、 Cl-、 Cu2+ |
| C.K+ 、Na+、NO3-、CO32- | D.Na+、Ba2+、OH-、SO42- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
A.用催化法处理汽车尾气中的CO和NO:CO+NO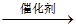 C+NO2 C+NO2 |
B.NO2与水的反应: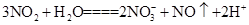 |
C.NH4HCO3溶于过量的NaOH溶液中: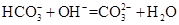 |
D.在1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、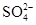 一定能大量共存 一定能大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在加入铝粉能产生氢气的溶液中: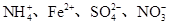 |
B.能使淀粉碘化钾试纸变蓝的溶液中: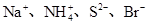 |
C.能使红色石蕊试纸变蓝的溶液中: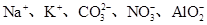 |
D.在含有大量Fe3+的溶液中: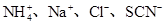 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu2+、Na+、OH- | B.H+、Cl-、CH3COO- |
| C.Fe3+、H+、NO3- | D.K+、Ca2+、CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.F- | B.ClO- | C.HSO3- | D.NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4+、Mg2+、SO42-、Cl- | B.Ba2+、K+、OH-、NO3- |
| C.Al3+、Cu2+、SO42-、Cl- | D.Na+、Ca2+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使甲基橙呈红色的溶液中:Na+、AlO2—、NO3—、CO32— |
| B.c(ClO-)=1.0 mol·L-1溶液:Na+、SO32-、S2-、Cl- |
| C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、C6H5O- |
D.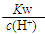 =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3— =0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3— |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
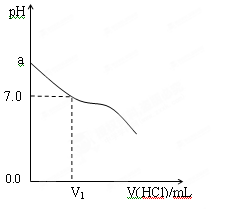
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com