
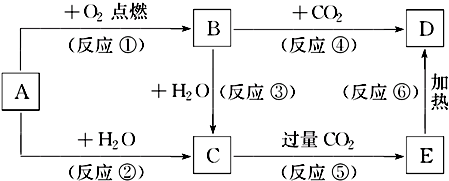
分析 A是一种常见单质,其焰色反应为黄色,则A是Na,B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3,Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3,再结合物质间的反应分析解答.
解答 解:A是一种常见单质,其焰色反应为黄色,则A是Na,B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3,Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3,
(1)通过以上分析知,A是Na、B是Na2O2,解:A是一种常见单质,其焰色反应为黄色,则A是Na,B、C、D、E是含A元素的常见化合物,Na在O2中燃烧生成B,B为Na2O2,Na和H2O反应生成NaOH和H2,Na2O2和水反应生成NaOH和O2,所以C是NaOH,NaOH和过量CO2反应生成NaHCO3,所以E是NaHCO3,Na2O2和CO2反应生成Na2CO3和O2,NaHCO3分解生成Na2CO3、CO2和水,所以D是Na2CO3,
(1)通过以上分析知,A是Na、B是Na2O2,D是Na2CO3,E是NaHCO3,
故答案为:Na;Na2O2;Na2CO3;NaHCO3;
(2)以上反应中①为钠的燃烧,②为Na与水反应,③为过氧化钠与水反应,④为过氧化钠与二氧化碳反应,均属于氧化还原反应,所以不属于氧化还原反应的有⑤⑥,
故答案为:⑤⑥;
(3)反应②的化学方程式为2Na+2H2O═2NaOH+H2↑,④的化学方程式为2Na2O2+2CO2═2Na2CO3+O2,⑥的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2Na+2H2O═2NaOH+H2↑;2Na2O2+2CO2═2Na2CO3+O2;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(4)反应⑤的离子方程式为OH-+CO2═HCO3-,C是NaOH,铝粉和C溶液反应的离子方程式为2Al+2H2O+2OH-=2 AlO2-+3H2↑,
故答案为:OH-+CO2═HCO3-;2Al+2H2O+2OH-=2 AlO2-+3H2↑.
点评 本题考查无机物的推断,明确焰色为黄色及A为单质为解答的突破口,熟悉钠及其化合物的性质是解答的关键,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸雨能使钢铁更容易发生电化学腐蚀 | |
| B. | 钢铁在潮湿的地窑中较易发生析氢腐蚀 | |
| C. | 铁锈的主要成分是Fe2O3•nH2O | |
| D. | 钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  分散系的分类 | |
| B. |  醋酸稀释 | |
| C. | 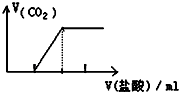 向Na2CO3溶液中逐滴滴入盐酸 | |
| D. | 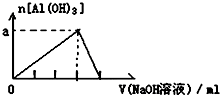 向AlCl3溶液中滴加过量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③④ | C. | ③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com