
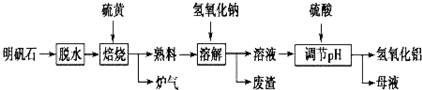
分析 根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2;
(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)“母液”中含有硫酸盐;
(5)依据化学方程式中定量关系确定明矾石的主要成分为K2SO4•Al2(SO4)3•2Al2O3•6H2O物质的量,结合铝元素守恒计算得到氢氧化铝的理论值.
解答 解:根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,
故答案为:2,3,2,9SO2;
(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:过滤,Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,
故答案为:K2SO4;Na2SO4;
(5)2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,依据铝元素守恒计算,若“焙烧”过程中恰好消耗48g硫黄物质的量=$\frac{48g}{32g/mol}$=1.5mol,反应的2Al2(SO4)3物质的量为1mol,K2SO4•Al2(SO4)3•2Al2O3•6H2O物质的量为1mol,
K2SO4•Al2(SO4)3•2Al2O3•6H2O~6Al(OH)3,
1 6×78
1mol m
则理论上最终可得到m=468g
故答案为:468.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中的反应、混合物分离提纯方法为解答的关键,注意离子反应、氧化还原反应及离子检验的综合应用,侧重分析、实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 26g乙炔所含共用电子对数目为3 NA | |
| B. | 标准状况下,11.2L的新戊烷所含的分子数为0.5 NA | |
| C. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA | |
| D. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
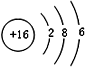 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
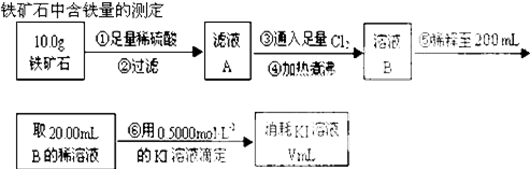
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com