
分析 根据m=ρV计算水的质量,再根据ω(溶质)=$\frac{m(溶质)}{m(溶质)+m(溶剂)}$×100%计算溶液的质量分数;
根据c=$\frac{1000ρω}{M}$计算溶液的物质的量浓度;
根据溶解度定义,计算100g水中溶解W的质量,即为W的溶解度.
解答 解:VmL水的质量=VmL×1g/mL=Vg,
故ω(溶质)=$\frac{wg}{wg+Vg}$×100%=$\frac{100w}{w+V}$%,
溶液的物质的量浓度=$\frac{1000×ρ×\frac{w}{w+V}}{M}$mol/L=$\frac{1000ρw}{M(w+V)}$mol/L,
W的溶解度=$\frac{100g}{Vg}$×wg=$\frac{100w}{V}$g,
故答案为:$\frac{100w}{w+V}$;$\frac{1000ρw}{M(w+V)}$mol/L;$\frac{100w}{V}$g.
点评 本题考查物质的量浓度及质量分数、溶解度有关计算,题目难度中等,注意有关定义的理解掌握,侧重于考查学生对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 铊既能与强酸反应又能与强碱反应 | B. | 能生成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样是两性氢氧化物 | D. | Tl(OH)3的碱性比Al(OH)3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率与I2的浓度有关 | |
| B. | HI在反应I中是氧化产物 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | 乙醛的分解速率主要取决于反应Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①②均为放热反应 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 若用标准状况下4.48L CH4还原NO2至N2,放出的热量是173.4kJ | |
| D. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H=-akJ•mol-1,a<574 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )| A. | N点时溶液中的溶质只有NaCl | |
| B. | 原混合溶液中c(MgCl2):c(AlCl3)=1:2 | |
| C. | c(NaOH)=c(HCl) | |
| D. | M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O所含电子数为10NA | |
| B. | 1mol Al与足量的稀盐酸溶液反应生成氢气1.5mol | |
| C. | 在标准状况下,0.5NA Cl2所占的体积约是11.2L | |
| D. | 在非标准状况下,22.4L O2含有的分子数一定不是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.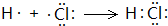 .
. ,尿素分子中σ键和π键数目之比为7:1.
,尿素分子中σ键和π键数目之比为7:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com