
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:选择题
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。下列说法正确的是( )

A.反应开始至a点时v(H2)=1 mol·L-1·min-1
B.若曲线Ⅰ对应的条件改变是升温,则该反应ΔH>0
C.曲线Ⅱ对应的条件改变是降低压强
D.T ℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:填空题
铝的阳极氧化是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。
某化学研究小组在实验室中按下列步骤模拟铝表面“钝化”的产生过程。
(1)配制实验用的溶液。要配制200 mL密度为1.2 g/cm3的溶质质量分数为16%的NaOH溶液,需要称取________g NaOH固体。
(2)把铝片浸入热的16%的NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗,写出除去氧化膜的离子方程式:________。
(3)按下图组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。

写出该过程中的电极反应式:
阳极:_________________________________________;
阴极:_________________________________________。
(4)断开电路,取出铝片,用质量分数为1%的稀氨水中和表面的酸液,再用水冲洗干净。写出该过程发生反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:填空题
某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
(1) | H2 |
|
|
|
|
(2) | CO |
|
|
| |
(3) | CH4 |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-2 原电池、常见的化学电源练习卷(解析版) 题型:选择题
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月。其电池反应为:2CH3OH+3O2+4OH-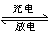 2CO32—+6H2O,则下列说法正确的是( )
2CO32—+6H2O,则下列说法正确的是( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32—+6H2O
C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
已知断开或形成1 mol化学键吸收或放出的能量称为化学键的键能,如H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。则下列有关工业合成氨反应的热化学方程式正确的是 ( )
A.N2(g)+3H2(g)  2NH3(g) ΔH=-93 kJ·mol-1
2NH3(g) ΔH=-93 kJ·mol-1
B.N2(g)+3H2(g)  2NH3(g) ΔH=+1471 kJ·mol-1
2NH3(g) ΔH=+1471 kJ·mol-1
C.N2(g)+3H2(g)  2NH3(g) ΔH=+93 kJ·mol-1
2NH3(g) ΔH=+93 kJ·mol-1
D.N2(g)+3H2(g)  2NH3(g) ΔH=-1471 kJ·mol-1
2NH3(g) ΔH=-1471 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.  H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)=
Ba(OH)2(aq)=  BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
元素周期表和元素周期律对化学学习具有指导意义,下列有关叙述正确的是( )
A.铅位于周期表中金属与非金属元素交界处,可做半导体材料
B.若存在简单阴离子R2-,则R一定属于第ⅥA族元素
C.S和Se属于第ⅥA族元素,H2S还原性比H2Se的强
D.元素原子最外层电子数较少的金属一定比最外层电子数较多的金属活动性强
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:选择题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是( )
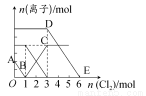
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中c(FeBr2)=6 mol·L-1
C.当通入Cl22 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com