
(16分)硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:

已知:(ⅰ)PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0
PbCl4-(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8, Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04
(1)步骤Ⅰ中生成PbCl2和S的离子方程式 ,加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式 。
(4)请用离子方程式解释滤液2加入H2O2可循环利用的原因 ,滤液3是 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的 PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
(16分)
(1)PbS+2Fe3++2Cl-= PbCl2+2Fe2++S(3分),抑制Fe3+、Pb2+的水解(2 分)
(2)用冰水浴使反应PbCl2(s)+2Cl-(aq) PbCl4-(aq)逆向移动,使PbCl4 -不断转化为PbCl2晶体而析出。(3分)
PbCl4-(aq)逆向移动,使PbCl4 -不断转化为PbCl2晶体而析出。(3分)
(3)PbCl2(s)+SO42-(aq) PbSO4 (s) +2Cl-(aq) (2分)
PbSO4 (s) +2Cl-(aq) (2分)
(4)2Fe2++ H2O2+2H+=2Fe3++2H2O(2分),盐酸(2分)
(5)PbSO4+2e-=Pb+ SO42-(2分)
【解析】
试题分析:(1)步骤Ⅰ中生成PbCl2和S,说明加入的盐酸、氯化铁与PbS发生氧化还原反应,S元素化合价升高,则铁元素的化合价降低,离子方程式为PbS+2Fe3++2Cl-= PbCl2+2Fe2++S;Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04,所以加入盐酸的另一个目的是为了控制PH值在0.5~1.0,原因是抑制Fe3+、Pb2+的水解;
(2)加入饱和食盐水后存在PbCl2(s)+2Cl-(aq) PbCl4-(aq) △H>0,在冰水浴中,温度较低,使平衡逆向移动,生成PbCl2晶体而析出;
PbCl4-(aq) △H>0,在冰水浴中,温度较低,使平衡逆向移动,生成PbCl2晶体而析出;
(3)Ksp(PbSO4)=1.08×10-8< Ksp(PbCl2)=1.6×10-5,根据沉淀的转化,PbCl2晶体转化为PbSO4沉淀是因为PbCl2中加入稀硫酸破坏了氯化铅的溶解平衡,使溶解平衡正向移动生成硫酸铅,离子方程式为PbCl2(s)+SO42-(aq) PbSO4 (s) +2Cl-(aq);
PbSO4 (s) +2Cl-(aq);
(4)滤液2的主要成分是氯化亚铁,与过氧化氢反应又生成氯化铁,作氧化剂使用,离子方程式为2Fe2++ H2O2+2H+=2Fe3++2H2O;由(3)可知氯化铅转化为硫酸铅同时生成氯化氢,所以滤液3是盐酸溶液;
(5)充电时是把电能转化为化学能,相当于电解池装置,所以阴极发生还原反应,Pb的化合价降低成为单质Pb,电极反应式为PbSO4+2e-=Pb+ SO42-
考点:考查对流程的分析,化学平衡的应用,电化学原理的应用


科目:高中化学 来源:2014-2015江苏省高二上学期期中化学(必修)试卷(解析版) 题型:选择题
下列有关物理量相应的单位,表达不正确的是
A.摩尔质量:g·mol-1
B.密度:g·mL-1
C.气体摩尔体积:L
D.阿伏加德罗常数:mol -1
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省越秀区高一下学期学业水平测试调研化学试卷(解析版) 题型:选择题
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省肇庆市第二学期高二期末统测化学试卷(解析版) 题型:选择题
下列说法正确的是
A.麦芽糖的水解产物能发生银镜反应
B.四氟乙烯(CF2=CF2)中所有的原子都在同一个平面上
C. 在酸性条件下水解产物是
在酸性条件下水解产物是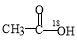 和
和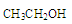
D.淀粉溶液加适量浓硫酸加热一会儿后,滴入银氨溶液无银镜生成,说明淀粉未水解
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省肇庆市第二学期高二期末统测化学试卷(解析版) 题型:选择题
如下图所示的分子酷似企鹅,化学家将该分子以企鹅来取名为Penguinone。下列有关说法
错误的是
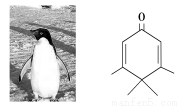
A.Penguinone分子式为C10H14O
B.Penguinone是一种芳香族化合物
C.Penguinone可以使酸性高锰酸钾溶液褪色
D.Penguinone能与H2发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省珠海市高三学业质量监测二模理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W > X
C.简单离子半径的大小顺序:r(Y+)>r(X—)
D.Y、W的最高价氧化物的水化物均能溶解金属Z
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:填空题
(16分)氯化亚铜(CuCl)是有机合成工业中应用较广泛的催化剂,它是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程如下:
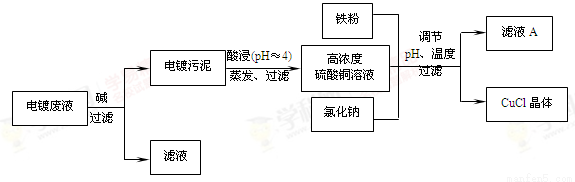
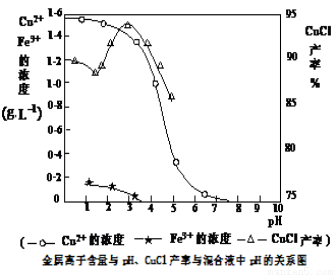
请回答下列问题:
(1)电镀污泥的主要成分是 (写化学式)。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为:
。
(3)析出CuCl晶体时的最佳pH在 左右。
(4)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的目的是 。
(5)从滤液A中可回收的主要物质是 (写化学式)。
(6)以碳棒为电极电解CuCl2溶液可得到CuCl。写出电解CuCl2溶液后的阴极上发生的反应为
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
mA(s)+nB(g) qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
qC(g)的可逆反应中,图甲在恒温条件达平衡时,B的体积分数(B%)与压强(p)的关系,图乙表示在一定条件下达到平衡(v正=v逆)后t1时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,有关叙述正确的是
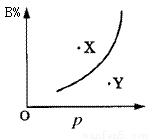
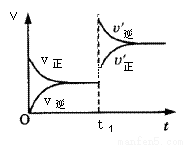
甲 乙
A.n<q B.n>q
C.正反应为放热反应 D.X点比Y点反应速率快
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
与22g CO2所含分子数相等的水的质量是
A.44g B.22g C.18g D.9g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com