
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:
![]()
![]()
![]() ―→
―→![]() ―→
―→![]()
粗盐中含Ca2+、Mg2+、Fe3+、SO![]() 等杂质,提纯的步骤有:
等杂质,提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发,其正确的操作顺序是( )
A. ⑤②③①⑥④⑦ B. ⑤①②③⑥④⑦
C. ⑤②①③④⑥⑦ D. ⑤③①②⑥④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备Cl2和新制的Cl2水,如图所示:

(1)装置中若无盛饱和食盐水的洗气瓶,将导致____________________。
(2)要证明Cl2与水反应是可逆反应,则证明Cl2水存在Cl2分子的现象是________,证明同时存在HCl和HClO的实验操作是_____________________。
(3)吸收Cl2尾气的化学反应方程式为________________________。
(4)用KClO3代替MnO2,不需加热就可以快速制得Cl2,该反应化学方程式为_____________________。
(5)有一种含氯氧化物,含氧量18.4%,与水反应,生成HClO,该氧化物的化学式是___________________,它属于___________。
A. 酸性氧化物 B. 碱性氧化物 C. 酸酐 D.氯化物
(6)新制氯水中加入少量Na2CO3溶液有气体产生,该反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) ΔH3=+23.5 kJ/mol
2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)的△H=________.
CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO: 与NO2 反应生成SO,和NO,将混合气体经冷凝分离出的SO,可用于制备硫酸。
①973 K时,测得:
NO2(g)![]() NO(g)+ 1/2O2(g) K1=0.018;
NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g)![]() SO3(g) K2=20;
SO3(g) K2=20;
则反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)的K3=________
SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为________。
③恒压下,SO2的分压PSO2随温度的变化如图所示:

当温度升高时,SO2(g)+NO2(g)![]() SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是___________.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是____;Ⅱ中0~20min,用NO3-表示的平均反应速率为____mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol/L | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol/L (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
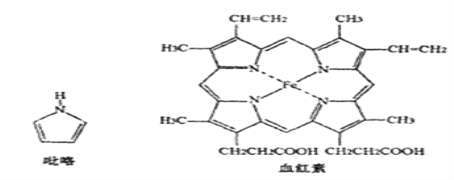
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
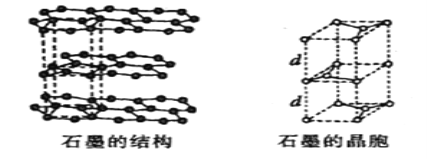
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)B的基态原子价电子排布式为____________________。BF3的立体构型是_____________________。
H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4 ]-,[B(OH)4]-中B的杂化轨道类型为__________________________。
(2)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_________________,其中三种元素的电负性由大到小的顺序是__________________________。
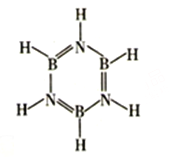
(3)硼与氮形成类似苯的化合物硼氮苯(B3N3H6),俗称无机苯(如图)。硼氮苯属于____________(填“极性”或“非极性”)分子,其间位上的二氯代物有______________种.
(4)NH4BF4 (氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有_________mol 配位键。
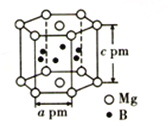
(5)硼与镁形成的高温超导材料晶体结构如图所示(B在六棱柱柱体内)。该六方晶胞中镁原子与硼原子的数量比为_____________,晶体密度d=_______________g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学发现一瓶失去标签的药品,取出少量,观察到该药品为白色固体,加入蒸馏水后,发现白色固体全部溶解,他认为该药品有可能是钠的化合物,需要用焰色反应来进一步验证。上述过程没有用到的科学探究方法是( )
A.假设法B.观察法C.比较法D.实验法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com