煤燃烧的反应热可通过以下两个途径来利用:
Ⅰ.利用煤在充足的空气中直接燃烧产生的反应热;
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧.
这两个过程的热化学方程式为:
Ⅰ.C(s)+O
2(g)═CO
2(g)△H=E
1①
Ⅱ.C(s)+H
2Og)═CO(g)+H
2(g)△H=E
2②
H
2(s)+
O
2(g)═H
2O(g)△H=E
3③
CO(s)+
O2(g)═CO
2(g)△H=E
4④
请填写下列空白:
(1)已知下列热化学方程式:
①H
2(s)+
O
2(g)=H
2O(g)△H=-241.8kJ/mol
②C(s)+
O
2(g)=CO(s)△H=-110.5kJ/mol
则水煤气能源的制取原理:C(s)+H
2O(g)=H
2(g)+CO(g)△H=
131.3KJ/mol
131.3KJ/mol
(2)在上述四个热化学方程式中,
②
②
(填编号)反应的△H>0;
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量正确的关系是(填序号)
C
C
;
A.I比Ⅱ多 B.I比Ⅱ少 C.I与Ⅱ在理论上相同
(4)根据能量守恒定律,E
1、E
2、E
3、E
4之间的关系为
E1=E2+E3+E4
E1=E2+E3+E4
.



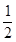 O2(g) = H2O(g) △H=E3 ③
O2(g) = H2O(g) △H=E3 ③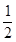 O2(g) = CO2(g) △H=E4 ④
O2(g) = CO2(g) △H=E4 ④