
【题目】下列说法或表示方法正确的是( )
A.等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量一样多
B.需要加热才能发生的反应一定是吸热反应
C.在101kpa时,2gH2完全燃烧,生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8kJ/mol
D.在强酸强碱稀溶液中:H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol,若将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ
【答案】D
【解析】A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,A不符合题意;
B、需要加热才能进行的化学反应不一定是吸热反应,如铝热反应,需要加热,但属于放热反应,B不符合题意;
C、在101kpa时,2gH2完全燃烧,生成液态水,放出285.8KJ热量,则氢气燃烧的热化学方程式表示为:H2(g)+ ![]() O2(g)═H2O(l);△H=﹣285.8KJ/mol,C不符合题意;
O2(g)═H2O(l);△H=﹣285.8KJ/mol,C不符合题意;
D、中和热是强酸强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸溶于水放热,将含1molNaOH的溶液和含0.5molH2SO4的浓硫酸混合,放出的热量大于57.3 kJ,D符合题意;
所以答案是:D
【考点精析】认真审题,首先需要了解吸热反应和放热反应(化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应).


科目:高中化学 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机化合物G是一种生物降解塑料,其合成路线如下:

己知:①![]() (R1、R2表示烃基)
(R1、R2表示烃基)
②E不能与银氨溶液发生反应,但能与Na反应。
③
(1)A的化学名称为________
(2)生成B的反应类型为________,生成C的反应类型为________
(3)由B生成C的化学方程式为________
(4)G的结构简式为________
(5)E的同分异构体很多,能同时满足下列条件的链状化合物共有________种(不含立体异构),其中核磁共振氢谱有4组峰值,且峰面积比为2:2:1:1的结构简式为_______。
①含有三种官能团;②能与新制的Cu(OH)2悬独液反应;③氧原子不与碳碳双键相连④与Na反应可放出氢气。
(6)写出用苯和CH3COCl为原料制备化合物![]() 的合成路线(无机试剂任选):_____。
的合成路线(无机试剂任选):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是

A. HS-在硫氧化菌作用下转化为SO42-的反应为:HS-+4H2O-8e-== SO42-+9H+
B. 电子从b流出,经外电路流向a
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A 元素原子的核电荷数为 8,其原子核内的质子数为_____,该元素原子的 二价阴离子中,核外电子数为_____,中子数为 9 的核素表示为_________。
(2)B 元素原子的一价阳离子的核外有 18 个电子,质量数为 40,该元素原子的原子核内中子数为_____
(3)A、B 形成 1:1 型化合物的相对分子质量为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 molL﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )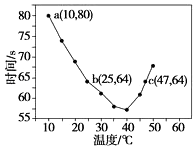
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10﹣5 molL﹣1s﹣1
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )
A.保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.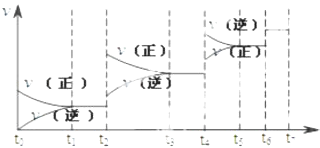
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com