
| 111.25KJ/mol |
| 0.125mol |


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
 xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol?L-1?min-1,下列说法正确的是( )
xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol?L-1?min-1,下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
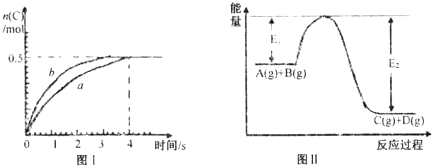
| A、此反应过程中的能量变化可用上图II表示 | B、此温度下,该反应的平衡常数的值为1 | C、该反应4s内平均速率v(A)=0.125mol?L-1?s-1 | D、若在恒温加大反应容器的容积条件下,该反应将按b曲线进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)Xe和F2反应,可得三种氟化物,视反应条件而定。下图表述的是将0.125mol/L Xe和1.225mol/L F2为始态得到 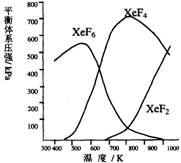 的生成物在平衡体系内的分压与反应温度的关系。
的生成物在平衡体系内的分压与反应温度的关系。
1.应在什么温度下制备XeF6和XeF4?
2.Xe和F2生成XeF6和XeF4,哪个反应放热更多?
生成 的反应放热更多。理由:
3.为有效地制备XeF2,应在什么反应条件下为好?简述理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com