
| A.称取1.06g碳酸钠固体溶于100mL水中,配制成0.1mol/ L的溶液 |
| B.向一定量的NaOH溶液中通入足量的CO2以制取纯净的Na2CO3溶液 |
| C.向某无色溶液中加入硝酸酸化的BaCl2溶液,以检验溶液中是否含有SO42-离子 |
| D.向水中加入乙醇来减缓钠与水的反应速度 |
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①②③④ | C.①③④ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.减压过滤是为了加快过滤速率,得到较大颗粒的晶体 |
| B.硫酸亚铁铵晶体过滤后用无水乙醇洗涤 |
| C.纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮 |
| D.欲分离硝酸钾和氯化钠的混合物(物质的量比为1:1),先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得硝酸钾晶体;将母液加热至大量晶体析出后,用余热蒸干,得氯化钠晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验内容 | 实验目的 |
| A | 在稀AgNO3溶液中加入少量NaCl溶液产生白色沉淀后再加入适量NaI溶液,出现黄色沉淀 | 说明Ksp(AgCl)>Ksp(AgI) |
| B | 分别向2支试管中加入等体积等浓度的Na2S2O3溶液,再向其中分别加入等体积不同浓度的H2SO4溶液 | 研究反应物浓度对化学反应速率的影响 |
| C | 向混有亚硫酸钠的硫酸钠溶液中加入适量的BaCl2溶液 | 检验SO42-存在 |
| D | 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液 | 制备Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤⑥ | B.①③⑤⑥ | C.②③④⑥ | D.③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
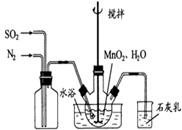
 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。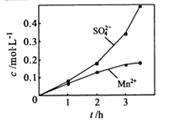
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com