
| A. | 氧化剂被还原,还原剂被氧化 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 失电子难的物质,获得电子的能力一定强 | |
| D. | 一种元素被氧化,肯定有另一种元素被还原 |
分析 A.得电子的物质为氧化剂,失电子的物质为还原剂;
B.同素异形体的转化不属于氧化还原反应;
C.稀有气体既不易失电子也不易得电子;
D.氧化还原反应中可能只有一种元素的化合价发生变化.
解答 解:A.得电子的物质为氧化剂,氧化剂被还原,失电子的物质为还原剂,还原剂被氧化,故A正确;
B.有单质参加或有单质生成的反应不一定是氧化还原反应,如:石墨转化为金刚石就不是氧化还原反应,故B错误;
C.稀有气体既不易失电子也不易得电子,所以失去电子难的原子不一定容易获得电子,故C错误;
D.氧化还原反应中可能只有一种元素的化合价发生变化,如氯气与水反应中Cl元素既被氧化又被还原,故D错误;
故选A..
点评 本题考查氧化还原反应,明确反应中元素的化合价及基本概念即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
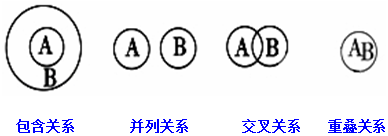
| A. | 化合物与氧化物属于交叉关系 | B. | 单质与非电解质属于包含关系 | ||
| C. | 溶液与分散系属于并列关系 | D. | 化合物与电解质属于包含关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL2.5mol/L NaCl溶液 | B. | 200mL2mol/L MgCl2溶液 | ||
| C. | 300mL3mol/L KCl溶液 | D. | 150mL2mol/L AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷室温下能与浓盐酸发生取代反应 | |
| B. | 由乙烯生成乙醇属于加成反应 | |
| C. | C4H9Cl有3种同分异构体 | |
| D. | 油脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| B. | 两清液混合,AgCl和AgI都沉淀 | |
| C. | 若取0.1435 g AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01 mol/L | |
| D. | 向AgI清液加入AgNO3,c(Ag+)增大,Ksp(AgI)也增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
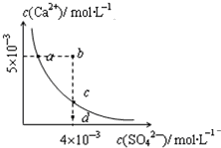 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水溶液中的沉淀溶解平衡曲线见如图.下列说法不正确的是( )| A. | CaSO4溶解在水中,c(Ca2+)=c(SO42-)=3×10-3mol/L | |
| B. | 在d点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| C. | a点对应的Ksp等于c点对应的Ksp | |
| D. | b点将有沉淀生成,平衡后溶液中c(SO42-)等于3×10-3mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
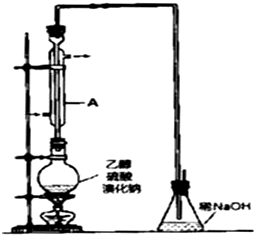 有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.
有机化工原料溴乙烷的沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是CH3CH2OH+HBr→CH3CH2Br+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
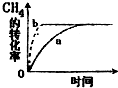 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | CO2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | D | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com