
【题目】830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H>0
试回答下列问题:
(1)请写出该化学反应的平衡常数表达式: .
(2)830K温度下,若起始时c(CO)=2molL﹣1 , c(H2O)=3molL﹣1 , 达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .
(3)若降低温度,该反应的K值将 , 该反应的正反应速率将; 该反应的逆反应速率将(均填“增大”“减小”或“不变”).
(4)若要提高CO的转化率,可采取的措施有: .
(5)830K温度下,若起始时c(CO)=1molL﹣1 , c(H2O)=2molL﹣1 , 反应进行一段时间后,测得H2的浓度为0.5molL﹣1 , 则此时该反应是否达到平衡状态(填“是”与“否”),你判断的依据是
【答案】
(1)K= ![]()
(2)0.5
(3)减小;减小;减小
(4)增大水蒸气浓度、减小二氧化碳、减小氢气浓度或升高温度
(5)否;浓度商= ![]() =0.33<K,平衡正向移动
=0.33<K,平衡正向移动
【解析】解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,则该反应化学平衡常数K= ![]() ;
;
所以答案是:K= ![]() ;(2)830K温度下,若起始时c(CO)=2molL﹣1 , c(H2O)=3molL﹣1 , 达到平衡时CO的转化率为50%,则反应的c(CO)=2mol/L×50%=1mol/L,
;(2)830K温度下,若起始时c(CO)=2molL﹣1 , c(H2O)=3molL﹣1 , 达到平衡时CO的转化率为50%,则反应的c(CO)=2mol/L×50%=1mol/L,
CO(g) | + | H2O(g) | = | CO2(g) | + | H2(g) | △H>0 | |
开始(mol/L) | 2 | 3 | 0 | 0 | ||||
反应(mol/L) | 1 | 1 | 1 | 1 | ||||
平衡(mol/L) | 1 | 2 | 1 | 1 |
化学平衡常数K= ![]() =
= ![]() =0.5,
=0.5,
所以答案是:0.5;(3)该反应的正反应是吸热反应,降低温度平衡逆向移动,化学平衡常数减小,降低温度导致活化分子百分数减小,正逆反应速率减小,
所以答案是:减小;减小;减小;(4)要提高CO转化率,可以通过增大水蒸气浓度、减小二氧化碳、减小氢气浓度、升高温度来实现,
所以答案是:增大水蒸气浓度、减小二氧化碳、减小氢气浓度或升高温度;(5)
CO(g) | + | H2O(g) | = | CO2(g) | + | H2(g) | △H>0 | |
开始(mol/L) | 2 | 3 | 0 | 0 | ||||
反应(mol/L) | 1 | 1 | 1 | 1 | ||||
平衡(mol/L) | 1 | 2 | 1 | 1 |
浓度商= ![]() =0.33<K,平衡正向移动,反应没有达到平衡状态,
=0.33<K,平衡正向移动,反应没有达到平衡状态,
所以答案是:否;浓度商= ![]() =0.33<K,平衡正向移动.
=0.33<K,平衡正向移动.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】4.8 g O2和0.2 mol CO2,O2的物质的量是______mol,它们的物质的量之比是________,CO2的质量是_______g,质量之比是________,在同温同压下的体积之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】获得中科院“百人计划”和“863”计划支持的环境友好型铝碘电池是以AlI3溶液为电解质溶液,以金属铝和附有碘单质的石墨为电极形成的原电池.已知电池总反应为2Al+3I2═2AlI3 . 下列说法不正确的是( )
A.电池工作时,溶液中的铝离子向正极移动
B.该电池可能是一种可充电的二次电池
C.消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多
D.该电池负极的电极反应为:Al﹣3e﹣═Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
A.NH4+为正四面体形
B.CS2为直线形
C.HCN为V形
D.PCl3为三角锥形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的大飞机C919其主结构材料大量使用了铝锂合金,利用的是铝锂合金的( )
A.低密度、高强度B.高强度、导热性
C.低密度、导电性D.导热性、导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O 
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为 .
(2)D中盛装的试剂为 .
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的 , 可观察到的现象 .
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4 , 为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3﹣能将H2SO3氧化为SO42﹣ |
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3﹣均能将H2SO3氧化为SO42﹣ , 不能说明谁先氧化H2SO3 , 他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中, .
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl﹣、Br﹣、Fe2+、I﹣的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答: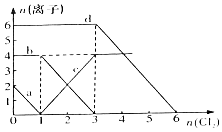
(1)a、c线分别代表溶液中、(填离子符号,下同)的变化情况.
(2)原溶液中Fe2+与Br﹣的物质的量为 .
(3)原混合溶液中FeI2的物质的量为 .
(4)当通入2mol Cl2时,溶液中离子反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.戊烷(C5H12)有两种同分异构体
C.C2H4、C3H6和 ![]() 中均含有碳碳双键
中均含有碳碳双键
D.糖类、油脂和蛋白质均可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)用量筒量取所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(填偏高、偏低、无影响).
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是
(4)将冷却后的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯次,洗涤液也要注入容量瓶中,并摇匀.如未冷却就转移,则所配溶液的浓度会(填偏高、偏低或无影响);若未洗涤烧杯,则所配溶液的浓度会(填偏高、偏低或无影响).
(5)加水至液面距刻度线下时,改用加水,使溶液的 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com