
 请回答:
请回答:分析 (1)根据待测液中加入酚酞,溶液为无色,反应完全后氢氧化钠过量,溶液变成红色判断达到终点现象;
(2)高锰酸钾具有强氧化性,应盛放在酸式滴定管中;
(3)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3•H2O为弱碱,据此分析;
(4)①醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH;
②Ⅰ.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,再结合电荷守恒判断;
Ⅱ.当c(Na+)=c(CH3COO-)+c(CH3COOH)时,根据物料守恒可知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,据此分析;
(5)依据溶度积常数计算得到.
解答 解:(1)盐酸中加入酚酞,溶液显示无色,盐酸反应完全后,加入氢氧化钠溶液后,溶液显示红色,所以滴定终点为滴入最后一滴氢氧化钠溶液,锥形瓶中溶液恰好出现红色且半分钟内红色不褪去;
故答案为:锥形瓶中溶液恰好出现红色且半分钟内红色不褪去;
(2)高锰酸钾具有强氧化性,能氧化橡皮管,应盛放在酸式滴定管甲中;
故答案为:甲;
(3)室温下,使用pH计测定0.1mol/LNH4Cl溶液的pH=5.12,即溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3•H2O为弱碱.
a、溶液的pH=5.12,即溶液显酸性,故溶液中c(H+)>c(OH-),故a正确;
b、NH3•H2O为弱碱,故NH4+是弱碱阳离子,在水溶液中能水解,但一般的单水解程度很微弱,故b正确;
c、溶液显酸性,说明NH4Cl为强酸弱碱盐,即NH3•H2O为弱碱,故c正确;
d、NH4Cl为强酸弱碱盐,在水溶液中能水解,而盐的水解能促进水的电离,故此溶液中由H2O电离出的c(H+)>10-7mol/L,故d错误;
e、物质的量浓度相等的氨水和盐酸等体积混合,会恰好完全反应得NH4Cl溶液,但由于NH4Cl为强酸弱碱盐,水解显酸性,故溶液的pH<7,故e错误.
故选abc;
(4)①醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸的pH,所以I是滴定醋酸的曲线,Ⅱ表示的是滴定盐酸的曲线,故答案为:II;
②Ⅰ.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故离子浓度的关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
Ⅱ.当c(Na+)=c(CH3COO-)+c(CH3COOH)时,根据物料守恒可知,加入的NaOH溶液的物质的量与醋酸的物质的量相同,此时两者恰好完全反应得醋酸钠溶液,而醋酸钠为强碱弱酸盐,水解显碱性,故溶液的pH>7;
故答案为:>.
(5)若处理后的废水中残留的c(Fe3+)=2×10-13mol•L-1,Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,计算得到c3(OH-)=2×10-25mol/L,则残留的Cr3+的浓度为Ksp[Cr(OH)3]=c(Cr3+)c3(OH-)=6.0×10-31 ,c(Cr3+)=3×10-6mol•L-1;
故答案为:3×10-6mol•L-1.
点评 本题考查了中和滴定、酸碱混合溶液定性判断、氧化还原滴定、溶度积,涉及弱电解质的电离、盐类水解、氧化还原反应计算应用等知识,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
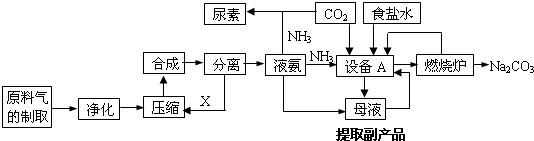
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
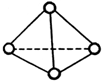 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )| A. | 1molN4气体转化为N2时要吸收206kJ能量 | |
| B. | N4是一种新型化合物 | |
| C. | 1molN4气体转化为N2时要放出740kJ能量 | |
| D. | N4是N2的同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的电离方程式为NaHCO3=Na++H++CO32- | |
| B. | 加水稀释后,n(H+)与n(OH-)的乘积变大 | |
| C. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 温度升高,c(HCO3-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
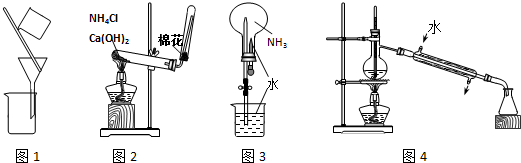
| A. | 用图1装置分离乙醇和乙酸 | B. | 用图2装置制取氨气 | ||
| C. | 用图3装置进行氨气的喷泉实验 | D. | 用图4装置进行石油的分馏实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性的溶液中,Na+、S2-、[Al(OH)4]-、SO32- | |
| B. | 酸性溶液中,Fe2+、Na+、NO3-、SO42- | |
| C. | 能与铝放出H2的溶液中、K+、Cu2+、NO3-、SO42- | |
| D. | 无色溶液中Ca2+、Cu2+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
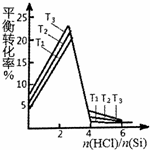 三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:| 反应的热化学方程式 | 平衡常数(300℃) | |
| 主反应 | Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ•mol-1 | K1(mol•L-1)-1 |
| 副反应 | Si(s)+4HCl(g)?SiHCl4(g)+2H2(g)△H=-240kJ•mol-1 | K2(mol•L-1)-1 |
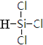 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com