

| A. | 用图甲所示装置先放出水相,再放出有机相 | |
| B. | 用图乙所示装置制取少量氯气 | |
| C. | 用图丙所示装置蒸发浓缩FeCl3溶液制备纯净的FeCl3•6H2O | |
| D. | 用图丁所示装置验证光亮的铁钉在食盐水中可发生吸氧腐蚀 |
分析 A.分液时,下层液体从下口倒出,上层液体从上口倒出;
B.浓盐酸和二氧化锰在加热条件下生成氯气,不加热不反应;
C.氯化铁水解生成氢氧化铁和盐酸,升高温度促进盐酸挥发,而促进水解;
D.强酸性条件下铁钉发生析氢腐蚀,弱酸性、中性条件下生铁发生吸氧腐蚀.
解答 解:A.分液时,下层液体从下口倒出,上层液体从上口倒出,所以水相从下口倒出,有机相从上口倒出,否则易产生杂质,故A错误;
B.浓盐酸和二氧化锰在加热条件下生成氯气,不加热不反应,该实验没有加热,所以得不到氯气,故B错误;
C.氯化铁水解生成氢氧化铁和盐酸,升高温度促进盐酸挥发,而促进水解,应该在HCl氛围中加热蒸发氯化铁,故C错误;
D.强酸性条件下铁钉发生析氢腐蚀,弱酸性、中性条件下生铁发生吸氧腐蚀,食盐水溶液呈中性,所以生铁发生吸氧腐蚀,可以通过导管中红墨水变化确定是吸氧腐蚀还是析氢腐蚀,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及金属腐蚀与防护、盐类水解、气体制备、分液等知识点,明确实验原理、实验操作、物质性质是解本题关键,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 氨气分子呈正四面体空间构型 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: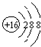 | D. | 氯化铵的电子式 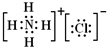 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个原子之间的相互作用叫做化学键 | |
| B. | 相邻原子之间的相互作用叫做化学键 | |
| C. | 一切物质中都存在化学键 | |
| D. | 破坏化学键一定要消耗能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
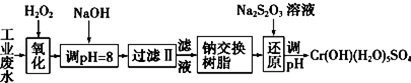
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 很多水果具有酸味,因此在化学上称为酸性食物 | |
| B. | 为增强婴儿的食欲,应在婴儿食品中多加着色剂 | |
| C. | 多吃含钙丰富的豆腐可预防骨质疏松 | |
| D. | 为摄取足够的蛋白质,应多吃肉、少吃豆制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
. .
. )的合成路线:
)的合成路线: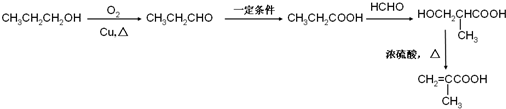 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

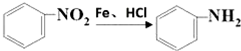
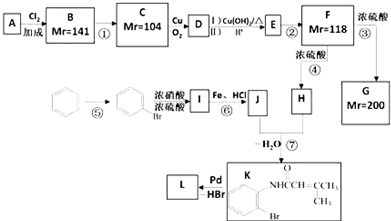
 .
.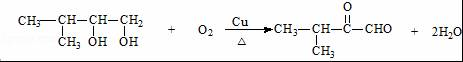 ;;F→G:
;;F→G: .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
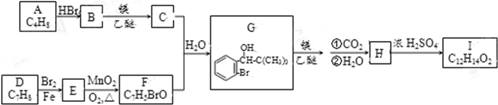
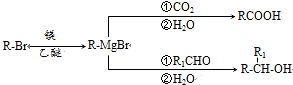
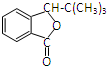 .
. .
.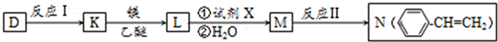
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 原子或分子相关信息 | 单质及其化合物相关信息 | |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的$\frac{1}{2}$ | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.
,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为6H++Al2O3=2Al3++3H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com