

| A. | Z的气态氢化物的稳定性在同主族元素中最强 | |
| B. | W的最高价氧化物对应的水化物是强酸 | |
| C. | W的非金属性比Z的弱 | |
| D. | Y的原子半径在同周期主族元素中最大 |
分析 由元素所在周期表中的位置可知X为He,Y为F,W为Cl,Z为S,
A.非金属性越强,气态氢化物的稳定性越强;
B.非金属性越强,最高价氧化物对应水合物的酸性越强;
C.同一周期中,原子序数越大,非金属性越强;
D.同一周期中,原子序数越大,原子半径越小.
解答 解:由元素所在周期表中的位置可知X为He,Y为F,W为Cl,Z为S,
A.同主族元素从上到下,元素的非金属性逐渐增强,对应的元素的非金属性越强,对应的氢化物越稳定,W为S,同主族元素中O对应的氢化物的稳定性最强,故A错误;
B.W为Cl,非金属性较强,对应的最高价氧化物对应的水化物为HClO4,为酸性最强的含氧酸,故B正确;
C.同周期元素从左到右,元素的非金属性逐渐增强,则W的非金属性比Z的强,故C错误;
D.同周期元素从左到右原子半径逐渐减小,则Y的原子半径在同周期主族元素中最小,故D错误;
故选B.
点评 本题考查原子结构与元素周期律关系和应用,题目难度中等,明确元素周期表结构为解答关键,注意熟练掌握元素周期律的递变规律,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | |
| B. | 氯化铁水解 Fe3++3H2O=Fe (OH)3↓+3H+ | |
| C. | 铜和稀硝酸反应 3Cu+8H++2NO-3=3 Cu2++2NO↑+4H2O | |
| D. | 铁和稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:As>Cl>P | B. | 非金属性:Cl>S>As | ||
| C. | 热稳定性:HCl>AsH3>PH3 | D. | 酸性:H3AsO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定 | |
| B. | 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,H2的燃烧热为571.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,含1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑥⑦ | C. | ③⑤⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步骤的目的是从海水中提取MgCl2 | |
| C. | 第④步电解时同时会产生氯气 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
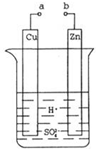 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com