
 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.| t/s | 0 | 500 | 1 000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
分析 (1)①反应达平衡后,再通入一定量N2O5,等效为增大压强,平衡逆向移动;
②根据v=$\frac{△c}{△t}$计算v(N2O5);
③若T2温度高,反应速率快,未到达平衡时,相同时间内N2O5的浓度减小更大,正反应为吸热反应,到达平衡时温度升高,平衡正向移动,N2O5的浓度会减小.而在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则此时N2O5的浓度为5mol/L-$\frac{1}{2}$×4.98mol•L-1=2.51mol/L,高于在T1温度下1000s时测得N2O5的浓度,说明T2温度下反应速率较慢;
(2)由N2O4制取N2O5需要是去电子,所以N2O5在阳极区生成,在硝酸参与下生成N2O5与氢离子.
解答 解:(1)①反应达平衡后,再通入一定量N2O5,等效为增大压强,平衡逆向移动,N2O5的转化率减小,
故答案为:减小;
②由表中数据可知,500s内N2O5的浓度变化量为5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率为$\frac{1.48mol/L}{500s}$=0.00296 mol•L-1•s-1,
故答案为:0.00296 mol•L-1•s-1;
③若T2温度高,反应速率快,未到达平衡时,相同时间内N2O5的浓度减小更大,正反应为吸热反应,到达平衡时温度升高,平衡正向移动,N2O5的浓度会减小.而在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则此时N2O5的浓度为5mol/L-$\frac{1}{2}$×4.98mol•L-1=2.51mol/L,高于在T1温度下1000s时测得N2O5的浓度,说明T2温度下反应速率较慢,故温度T2<T1,
故答案为:<;
(2)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,在硝酸参与下生成N2O5与氢离子,电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+,
故答案为:阳极;N2O4+2HNO3-2e-═2N2O5+2H+.
点评 本题考查化学平衡计算与影响因素、化学反应速率计算、电化学等知识点,(2)中③学生容易考虑反应速率问题,忽略是否到发生平衡移动,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 检验NH4+时,加浓NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口检验,若试纸变蓝,则可证明原溶液中含有NH4+ | |
| B. | 检验SO42-时,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,则可证明含SO42- | |
| C. | 用天平和小烧杯称量5.40gNaOH固体 | |
| D. | 用饱和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈红褐色即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.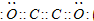 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 4 | 18 | 75 |
| 溶解度/[g•(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
 (用化学方程式表示).
(用化学方程式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com