
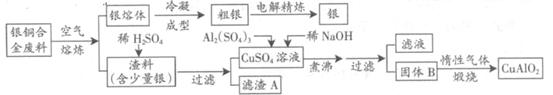
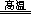 CuAlO2 + ↑。
CuAlO2 + ↑。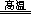 4 CuAlO2 +O2↑(2分)
4 CuAlO2 +O2↑(2分) CuO+H2O,由于Al(OH)3开始分解的温度为450℃,在惰性气体中煅烧时发生的反应为2Al(OH)3
CuO+H2O,由于Al(OH)3开始分解的温度为450℃,在惰性气体中煅烧时发生的反应为2Al(OH)3 Al2O3+3H2O、4CuO
Al2O3+3H2O、4CuO 2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH是强碱,若强碱溶液过量,则过量的NaOH能溶解部分或全部氢氧化铝,其离子方程式为Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-,这将导致目标产物产量的减少;(3)根据氧化还原反应的特征推断,铜元素由+2价降为+1价,铝元素化合价不变,由此推断反应前后升价元素一定是氧,且化合价由—2价升为相邻的0价,即缺少的生成物为氧气;根据化合价升降法配平可得:4CuO+2Al2O3
2Cu2O+O2↑;氢氧化铝是两性氢氧化物,NaOH是强碱,若强碱溶液过量,则过量的NaOH能溶解部分或全部氢氧化铝,其离子方程式为Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+OH-==[Al(OH)4]-,这将导致目标产物产量的减少;(3)根据氧化还原反应的特征推断,铜元素由+2价降为+1价,铝元素化合价不变,由此推断反应前后升价元素一定是氧,且化合价由—2价升为相邻的0价,即缺少的生成物为氧气;根据化合价升降法配平可得:4CuO+2Al2O3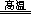 4CuAlO2+O2↑(或者根据设1法配平,先设反应物中氧化铝的系数为1,根据铝守恒可得生成物CuAlO2的系数为2,根据铜守恒可得反应物CuO的系数为2,根据氧守恒可得氧气的系数为1/2,即2CuO+1Al2O3
4CuAlO2+O2↑(或者根据设1法配平,先设反应物中氧化铝的系数为1,根据铝守恒可得生成物CuAlO2的系数为2,根据铜守恒可得反应物CuO的系数为2,根据氧守恒可得氧气的系数为1/2,即2CuO+1Al2O3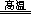 2CuAlO2+1/2O2↑,系数加倍后即可得到4CuO+2Al2O3
2CuAlO2+1/2O2↑,系数加倍后即可得到4CuO+2Al2O3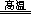 4CuAlO2+O2↑);(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×63.5%,铜元素的相对原子质量为63.5,由m/M=n可求铜的物质的量为5.0×103g×63.5%÷63.5g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;(5)胆矾的化学式为CuSO4?5H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
4CuAlO2+O2↑);(4)5.0kg=5.0×103g,银铜合金废料中铜的质量为5.0×103g×63.5%,铜元素的相对原子质量为63.5,由m/M=n可求铜的物质的量为5.0×103g×63.5%÷63.5g/mol=50mol,根据铜守恒可得转化关系式:Cu~CuAlO2,其中CuAlO2与Cu的物质的量之比等于系数之比,则铜完全转化可以变为50mol CuAlO2;根据铝守恒可得转化关系式:Al2(SO4)3~2CuAlO2,其中Al2(SO4)3与CuAlO2的物质的量之比等于系数之比,则至少需要25mol Al2(SO4)3;由V=n/c可求至少需要硫酸铝溶液的体积为25mol÷1.0mol/L=25L;(5)胆矾的化学式为CuSO4?5H2O,是硫酸铜溶液结晶析出的结晶水化合物,根据混合物分离和提纯的方法推断,从硫酸铜溶液中得到胆矾的基本操作是蒸发浓缩、冷却结晶、过滤、洗涤和干燥。

科目:高中化学 来源:不详 题型:单选题
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c > b > d > a | B.b > a > d > c | C.a > b > c > d | D.d > c > b > a |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| A.硬度比钢小,熔点比钢高 | B.不能与盐酸反应 |
| C.与不锈钢成分相同 | D.在冷的浓硫酸中钝化 |
 6Cu+SO2↑,该反应的氧化剂是
6Cu+SO2↑,该反应的氧化剂是 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
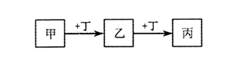
| A.若甲是AlCl3溶液,则丁可能是NaOH溶液 |
| B.若甲是Fe,则丁可能是Cl2 |
| C.若丁是CO2,则甲可能为Mg |
| D.若丁是O2,则乙、丙的相对分子质量可能相差16 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al2O3熔点很高,可用作耐火材料 |
| B.高纯度的硅单质用于制作光导纤维 |
| C.铝热反应是炼铁最常用的方法 |
| D.N2与O2在放电条件下直接化合生成NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com