
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X H2O ,并测定该晶体中结晶水含量。请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响___ _(填“有”或“无”。其原因是_____________________________________________,该步实验的关键是保证 过量(填“硫酸”或“铁屑”)。
(2) FeSO4在不同温度下溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
由于铁屑中含有C、Si等杂质,为了使FeSO4 溶液的浓度增大,便于反应后分离溶液和残渣。该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止_______________________________________________。你认为实验时的水浴温度最好控制在__________℃左右。从滤液中获得FeSO4?xH2O,下列操作中不需要的是 ( )
(A)冷却 (B)蒸发 (C)结晶
(D)洗涤 (E)过滤
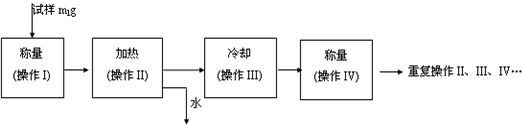
(3) 以下是测定FeSO4?xH2O中结晶水含量的实验流程。(称量仪器为电子天平)
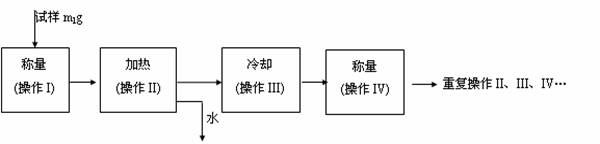
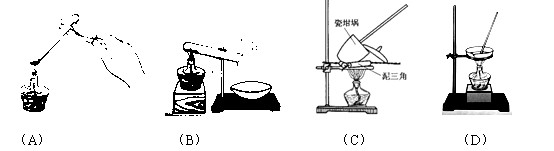
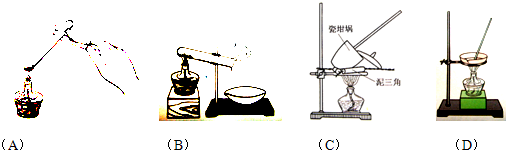
① 其加热装置正确的是( )
② 重复操作II、III、IV,直到连续两次称量结果相差不超过 g。
③ 操作III必须要在 中(填仪器名称)进行。
(4)以下结晶水含量测定操作正确的是( )
A、加热时,晶体溅出坩埚,再加些FeSO4?X H2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次。
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现 ;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气
科目:高中化学 来源: 题型:阅读理解
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
查看答案和解析>>
科目:高中化学 来源:2014届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
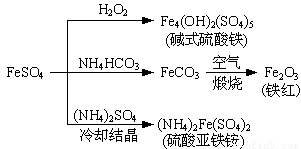
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市高三第三次模拟化学试卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通、泰州、扬州连云港淮安高三第三次调研5月测试化学卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是
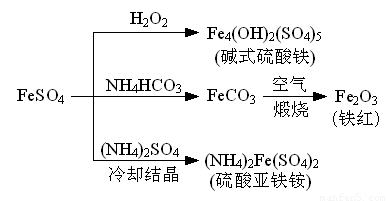
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com