

分析 由题给数据可知Fe3+易生成Fe(OH)3沉淀而除去,加入氧化剂X的目的是把亚铁离子氧化,为避免引入新杂质,应用过氧化氢;加入试剂Y的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,
(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(2)物质Y的作用是调节溶液的pH,据此来选择合适的试剂;
(3)加碱的同时Cu2+也会生成沉淀;
(4)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发);
(5)加入氧化剂,将Fe2+氧化为Fe3+;
(6)CuO能促进三价铁离子的水解;
解答 解:(1)根据题意,加入氧化剂X可把Fe2+氧化为Fe3+,而没有增加新杂质,所以X为H2O2,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:b;2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)结合题示,调节pH至3.7,使Fe3+全部沉淀,所以Y最好为CuO或Cu(OH)2,
故答案为:氧化铜或氢氧化铜;
(3)加碱的同时Cu2+也会生成沉淀,
故答案为:不能;加碱的同时Cu2+也会生成沉淀;
(4)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl气氛中采用浓缩后冷却结晶的方法,以得到CuCl2•2H2O的晶体,
故答案为:不能;应在氯化氢气氛中浓缩后冷却结晶;
(5)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,
故答案为:将Fe2+氧化为Fe3+,再除去;
(6)除去Fe3+的有关离子方程式Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O,
故答案为:Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O.
点评 本题考查阅读获取信息能力、对工艺流程理解与实验条件控制、实验方案的评价、物质分离提纯除杂等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4、CH3CH2OH、CH3COONa和CaO分别属于酸、碱、盐和氧化物 | |
| B. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 | |
| C. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| D. | 日常生活中无水乙醇常用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
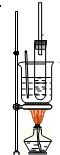 实验室制取硝基苯的方法如图所示:
实验室制取硝基苯的方法如图所示: ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
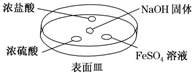
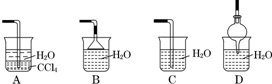


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗n molA,同时消耗3n mol B | |
| B. | A、B、C三者的浓度相同 | |
| C. | 容器内气体的压强不随时间的变化而变化 | |
| D. | 混合气体的密度不在发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在Cl2中燃烧,产生苍白色火焰,瓶口有白雾生成 | |
| B. | 铁丝在Cl2中燃烧,产生棕红色的烟 | |
| C. | 钠在Cl2中燃烧,生成白色的雾 | |
| D. | 铜丝在Cl2中燃烧,生成棕黄色的烟 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com