
| A. | 按系统命名法,有机物 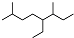 可命名为3,7-二甲基-4-乙基辛烷 可命名为3,7-二甲基-4-乙基辛烷 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | 谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构) | |
| D. | 在一定条件下,1.0 mol的  最多能与含3.0 mol NaOH的溶液完全反应 最多能与含3.0 mol NaOH的溶液完全反应 |
分析 A.根据烷烃命名原则:长、多、近、小、简,据此命名即可;
B.环己醇中碳连接4个原子或原子团,为四面体结构;
C.缩合是氨基和羧基形成肽键,谷氨酸分子不对称;
D.能和氢氧化钠反应的基团为酚羟基、卤素原子和铵根离子.
解答 解:A.命名时要使最先遇到的简单取代基位次最小,正确的命名为:2,6-二甲基-5-乙基辛烷,故A错误;
B.环己醇中碳连接4个原子或原子团,为四面体结构,所有原子不可能共平面,故B错误;
C.缩合是氨基和羧基形成肽键,谷氨酸分子不对称,缩合最多可形成2种二肽,故C错误;
D.能和氢氧化钠反应的基团为酚羟基、卤素原子和铵根离子,各需要1mol氢氧化钠,故D正确;
故选D.
点评 本题考查有机物的命名、结构与性质,把握官能团与性质的关系为解答的关键,题目难度不大.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 为了保证食物的安全与色香味,我们应该研发高效低毒的农药,科学使用食品添加剂,并用聚乙烯塑料袋进行包装 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和 CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,但不能提高该反应的平衡转化率 | |
| C. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 推广乙醇汽油,CO2的捕捉与封存都符合低碳经济与低碳生活 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(C${{O}_{3}}^{2-}$)>c(HC${{O}_{3}}^{-}$)>c(OH-) | |
| B. | 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L盐酸混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(N${{H}_{4}}^{+}$)>c(OH-) | |
| D. | 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W三种元素组成化合物的水溶液可能显碱性 | |
| B. | Z与Y、Z与W形成的化合物的化学键类型完全相同 | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | 因非金属性Y>R,所以X与Y组成化合物的沸点低于X与R组成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2S溶液中,S2-的数目小于0.1 NA | |
| B. | 0.1 mol丙烷中含有的共价键数目为0.8 NA | |
| C. | 标准状况下,11.2 L甲醇中含有的分子数目为0.5 NA | |
| D. | 0.1 mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
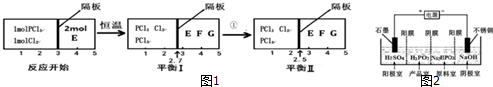
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | A | B | C | D | E |
| 性质或结构信息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,乙具有弱酸性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E是一种气态氧化物丙,丙相对于空气的密度为3.0,溶于水可得只含单一溶质的弱酸性溶液,该溶液在放置过程中其酸性会增强 |
 ;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.
;并说明丙的水溶液在放置过程中其酸性会增强的原因(用化学方程式表示)2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别为 I1=738,I2=1451,I3=7733,I4=10540(单位:kJ/mol) |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
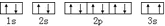 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com