广东省近几年来的乙烯产量一直居全国之首.工业上常用乙烷裂解制取乙烯:C
2H
6(g)?C
2H
4(g)+H
2(g)△H
回答下列问题:
(1)C
2H
6分子中,存在的共价键类型有:
非极性键、极性键
非极性键、极性键
.
(2)下表为一些共价键在断裂(或生成)时,所吸收(或放出)的能量:
| 化学键 |
H-H |
C-H |
C-C |
C=C |
吸收或放出的能量
E/(kJ.mol-1) |
435.3 |
414.4 |
345.6 |
615.3 |
上述反应的△H=
+123.8kJ.mol-1
+123.8kJ.mol-1
.
(3)将1.00mol乙烷充入容积为1.00L的恒容密闭容器,一定温度下发生反应,平衡时测得乙烷的物质的量为0.20mol.求该温度下反应的平衡常数及乙烷的平衡转化率.(写出计算过程)
(4)实际生产中,常在恒温恒压下采用加入水蒸气的方法来提高乙烯的产率(水蒸汽在此条件下不参与反应),原因是
恒温恒压下加入水蒸气,系统总压不变,体积增大,各物质的浓度同等程度减小,浓度商Qc<平衡常数K.
平衡向着正反应方向移动,所以乙烯的产率提高
恒温恒压下加入水蒸气,系统总压不变,体积增大,各物质的浓度同等程度减小,浓度商Qc<平衡常数K.
平衡向着正反应方向移动,所以乙烯的产率提高
.

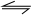 C2H4(g)+H2(g)
C2H4(g)+H2(g)
