
| A. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| B. | 淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物 | |
| C. | 在蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,虽再加水,也不溶解 | |
| D. | 北京奥运吉祥物“福娃”的材质是PVC(聚氯乙烯),其单体的结构是CH2=CHCl |
分析 A.分子式相同、结构不同的有机物互称同分异构体;
B.油脂属于小分子化合物;
C.蛋白质的盐析具有可逆性;
D.聚氯乙烯的单体是氯乙烯.
解答 解:A.淀粉和纤维素聚合度不同,导致其分子式不同,所以不属于同分异构体,故A错误;
B.脂肪为油脂,其相对分子质量较小,所以不属于高分子化合物,故B错误;
C.在蛋白质溶液中加入饱和硫酸铵溶液,发生盐析,盐析可逆,再加水,蛋白质溶解,故C错误;
D.聚氯乙烯由氯乙烯加聚生成,其单体的结构是CH2=CHCl,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确基本概念、物质性质是解本题关键,注意蛋白质盐析和变性的区别,易错选项是A.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用加热灼烧的方法鉴别铁粉和炭粉 | |
| B. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 | |
| C. | 用丁达尔效应鉴别FeCl2溶液和FeCl3溶液 | |
| D. | 用氨水鉴别MgSO4溶液和Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
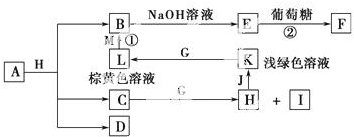
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 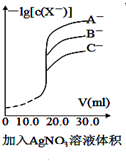 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图可确定首先沉淀的是C- | |
| B. | 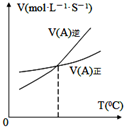 图表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应 | |
| C. | 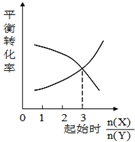 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| D. | 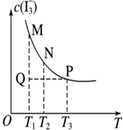 图表示溶液中反应:I2+I-?I3- 平衡c(I3-)随温度变化,反应速度V(正)M<V(逆)N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
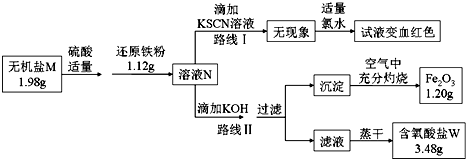
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| … | W | ||
| X | Y | … | Z |
| A. | 离子半径:X>Y>Z>W | |
| B. | 气态氢化物的稳定性W>Z | |
| C. | 元素X与Z形成的化合物中只含有离子键 | |
| D. | 最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
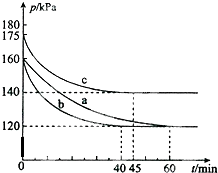 在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )
在10L的恒容密闭容器中,发生反应:PCl3(g)+Cl2(g)?PCl5(g)△H<0 若起始时PCl3(g)和Cl2(g)均为0.2mol,在不同条件下进行a、b、c三组实验,每一组实验都是在恒温恒容条件下进行,反应体系总压强随时间的变化如图所示.下列说法中正确的是( )| A. | 与实验a相比,实验b升高了温度,实验c加入了催化剂 | |
| B. | 从反应开始至刚达平衡时,实验b的化学反应速率ν(PCl5)=5×10-4mol/(L.min) | |
| C. | 实验c达平衡时,PCl3(g)的转化率为 60% | |
| D. | 在实验a条件下,该反应的平衡常数K=100 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com