


| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/ mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
 2NO(g)
2NO(g)  H>0
H>0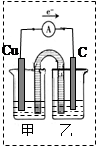
 2NO(g)
2NO(g)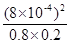 =4×10-6
=4×10-6

科目:高中化学 来源:不详 题型:填空题
 N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
 N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。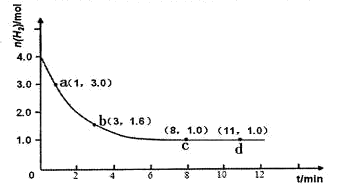

 CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。
CH3COO[Cu(NH3)3]?CO △H<0。写出提高CO吸收率的其中一项措施: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.室温下,pH=5.6的NaHSO3溶液中c( SO32-)-c( H2SO3)= 10-5.6-10-8.4 |
| B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.吸热反应只有在加热条件下才能发生,故水不加热不电离 |
| D.过量的氨水和盐酸反应所得溶液不可能为酸性,但可能为中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,| A.1.8Q kJ | B.2Q kJ | C.Q kJ | D.0.9 QJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
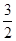 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1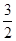 S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2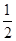 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3| A.△H4=2/3(△H1+△H2-3△H3) |
| B.△H4=2/3(3△H3-△H1-△H2) |
| C.△H4=3/2(△H1+△H2-3△H3) |
| D.△H4=3/2(△H1-△H2-3△H3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 L氟化氢气体分解成1 L氢气和1 L氟气吸收270 kJ热量 |
| B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出热量小于270 kJ |
| C.在相同条件下,1 mol氢气与1 mol氟气的能量总和大于2 mol氟化氢气体的能量 |
| D.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-67.7 kJ·mol-1 | B.-43.5 kJ·mol-1 |
| C.+43.5 kJ·mol-1 | D.+67.7 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com