
分析 根据n=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=cV计算,相对原子质量在数值上等于摩尔质量.
解答 解:(1)含6.02×1022个分子的CO中,n(CO)=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}mo{l}^{-1}}$=0.01mol;
故答案为:0.01mol;
(2)2mol H2SO4的m(H2SO4)=nM=2mol×98g/mol=196g;
故答案为:196g;
(3)7g N2的物质的量n=$\frac{7g}{28g/mol}$=0.25mol,所以在标准状况下的V(N2)=n×Vm=5.6L;
故答案为:5.6L;
(4)5L 2mol/L NaOH溶液中所含NaOH的n=cV=5L×2mol/L=10mol,m(NaOH)=nM=10mol×40g/mol=400g;
故答案为:400g;
(5)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的物质的量为$\frac{0.4mol}{2}$=0.2mol,ACl2的摩尔质量是$\frac{19g}{0.2mol}$=95 g•mol-1,则A的相对原子质量为95-35.5×2=24,
故答案为:24.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的计算,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、Fe3+、CO32- | B. | H+、Cl-、ClO-、Ca2+ | ||
| C. | Mg2+、Cl-、NO3-、K+ | D. | K+、ClO-、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(I-)/mol•L-1 | c(Fe3+)/mol•L-1 | v/mol•L-1•s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
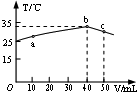
| A. | HA溶液的物质的量浓度为0.01mol/L | |
| B. | a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+) | |
| C. | b→c的过程中,温度降低的主要原因是溶液中A-发生了水解反应 | |
| D. | 25℃时,HA的电离平衡常数K约为1.25×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯气与足量的铁反应,转移电子数为0.2NA | |
| B. | 标准状况下,2.24L NO2所含电子总数为3.9 NA | |
| C. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数大于0.1 NA | |
| D. | 常温常压下,将0.1mol氯气通入水中发生化学反应,转移电子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com