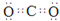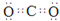【答案】
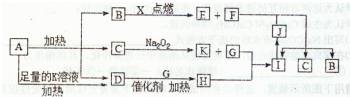
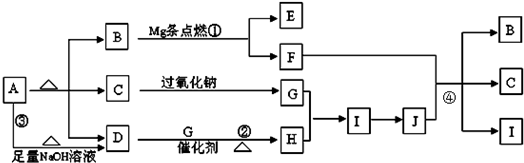
分析:A在加热的条件下能与NaOH反应生成D为常温下气态物质,说明A为铵盐,D为NH
3,A分解得到等物质的量的B、C、D,
B为常温下为气体,又能与镁反应,考虑B为CO
2,C能与过氧化钠反应,考虑C为H
2O,G为O
2,则A为NH
4HCO
3,
氨气与氧气反应生成NO,NO与氧气反应生成NO
2,H为NO,I为NO
2,则J为HNO
3,镁与二氧化碳反应生成MgO与C,C与浓硝酸反应生成CO
2、NO
2、H
2O,E为MgO,F为碳,符合转化关系,据此解答.
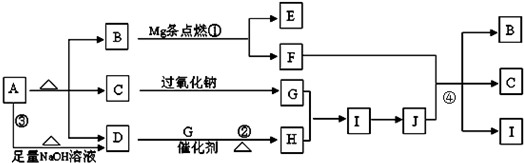
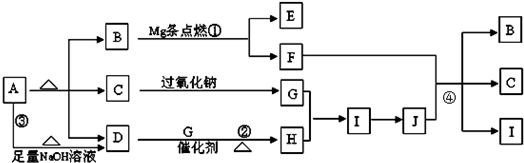
解答:解:A在加热的条件下能与NaOH反应生成D为常温下气态物质,说明A为铵盐,D为NH
3,A分解得到等物质的量的B、C、D,
B为常温下为气体,又能与镁反应,考虑B为CO
2,C能与过氧化钠反应,考虑C为H
2O,G为O
2,则A为NH
4HCO
3,
氨气与氧气反应生成NO,NO与氧气反应生成NO
2,H为NO,I为NO
2,则J为HNO
3,镁与二氧化碳反应生成MgO与C,C与浓硝酸反应生成CO
2、NO
2、H
2O,E为MgO,F为碳,符合转化关系,
(1)由上述分析可知,B为CO
2,碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,D为NH
3,N原子形成3个N-H单键,含有1对孤对电子,采取sp
3杂化,分子的空间构型为三角锥型,故答案为:O=C=O,三角锥型;
(2)反应①是镁在二氧化碳中燃烧生成氧化镁与碳,反应方程式为:2Mg+CO
2
2MgO+C,
反应④是碳与浓硝酸反应生成二氧化碳、二氧化氮、水,反应方程式为:C+4HNO
3 (浓)

CO
2↑+4NO
2↑+2H
2O,
故答案为:2Mg+CO
2
2MgO+C,C+4HNO
3 (浓)

CO
2↑+4NO
2↑+2H
2O;
(3)反应③是碳酸氢铵与氢氧化钠反应生成氨气、碳酸钠、水,离子方程式为:NH
4++HCO
3-+2OH
-═NH
3↑+CO
32-+2H
2O,
故答案为:NH
4++HCO
3-+2OH
-═NH
3↑+CO
32-+2H
2O;
(4)有H
2O参加且只做还原剂的氧化还原反应,为氟气与水反应生成HF与氧气,反应方程式为2F
2+2H
2O=4HF+O
2,
故答案为:2F
2+2H
2O=4HF+O
2;
(5)将NH
3和O
2以1:2混合在催化剂的作用下充分反应,没有无气体剩余,发生的总反应式为:NH
3+2O
2=HNO
3+H
2O,生成的HNO
3与H
2O的物质的量之比为1:1,故生成硝酸溶液中溶质的质量为

×100%=

,故答案为:

.
点评:以框图的形式考查Na、N、Mg元素单质及其化合物的性质与转化、常用化学用语、化学计算等,题目推断难度较大,根据A的分解产物及特点进行猜测,然后进行验证,需要学生熟练掌握元素化合物知识,(5)中计算,注意利用总化学方程式解答.

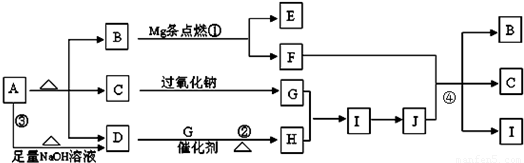
 2MgO+C,
2MgO+C, CO2↑+4NO2↑+2H2O,
CO2↑+4NO2↑+2H2O,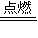 2MgO+C,C+4HNO3 (浓)
2MgO+C,C+4HNO3 (浓) CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O; ×100%=
×100%= ,故答案为:
,故答案为: .
.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案