
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd(OH)2+2Ni(OH)2![]() Cd+2NiOOH+2H2O,有关这个电池的说法正确的是( )
Cd+2NiOOH+2H2O,有关这个电池的说法正确的是( )
A.放电时负极附近的溶液的碱性不变
B.放电时电解质溶液中的OH-向正极移动
C.原电池时的正极反应是:Cd(OH)2+2e-=Cd+OH-
D.原电池时的负极反应是:Cd-2e-+2OH-=Cd(OH)2
【答案】D
【解析】
由Cd(OH)2+2Ni(OH)2![]() Cd+2NiOOH+2H2O,可知,放电时Cd是负极,发生氧化反应,NiOOH是正极,发生还原反应;充电时Ni(OH)2在阳极发生氧化反应,Cd(OH)2在阴极发生还原反应。
Cd+2NiOOH+2H2O,可知,放电时Cd是负极,发生氧化反应,NiOOH是正极,发生还原反应;充电时Ni(OH)2在阳极发生氧化反应,Cd(OH)2在阴极发生还原反应。
A.放电时负极反应是Cd-2e-+2OH-=Cd(OH)2,所以负极附近的溶液的碱性减弱,故A错误;
B.放电时电解质溶液中的OH-向负极移动,故B错误;
C.原电池的正极是NiOOH发生还原反应:2NiOOH+2e-+2H2O=2Ni(OH)2+2OH-,故C错误;
D.原电池的负极是Cd发生氧化反应:Cd-2e-+2OH-=Cd(OH)2,故D正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是( )
A.气态氢化物的稳定性:HBr>HIB.在短周期中,金属性最强的元素是钠,非金属性最强的元素是氟
C.向Na2SO3溶液中加盐酸,有气泡产生D.镁条、铝片分别与同浓度盐酸反应,Mg的反应更容易
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如图所示有机物分子的叙述错误的是( )

A. 碱性条件下能发生水解,1 mol该有机物完全反应消耗8 mol NaOH
B. 常温下,能与Na2CO3溶液反应放出CO2
C. 与稀硫酸共热,能生成两种有机物
D. 该有机物遇FeCl3溶液显色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol·L-1w溶液中,![]() 。上述物质的转化关系如图所示。下列说法正确的是
。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:![]() D. y、w含有的化学键类型完全相同
D. y、w含有的化学键类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化氮(NCl3)是一种消毒剂,可利用氯气与氯化铵溶液反应来制备。已知:三氯化氮的相关性质如下:
物理性质 | 化学性质 |
黄色油状液体,熔点为-40℃,沸点为 71℃,不溶于冷水、易溶于有机溶剂,密度为 1.65 gcm-3 | 95℃时爆炸,热水中发生水解 |
某小组同学选择下列装置(或仪器)设计实验制备三氯化氮并探究其性质:
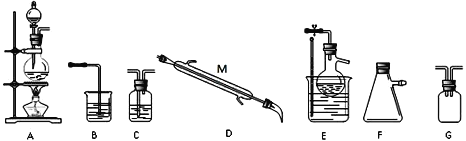
(1)NCl3的电子式为__________________;仪器 M 的名称是______________;
(2)如果气流的方向从左至右,装置连接顺序为A、G、_____________、B。(注明:F仪器使用单孔橡胶塞)
(3)C中试剂是_________________;B装置的作用是________________;
(4)写出E装置中发生反应的化学方程式_______________________________________
(5)当E装置的烧瓶中出现较多油状液体时停止反应。控制水浴加热温度为__________;
(6)已知三氯化氮不具有漂白性,三氯化氮与热水反应的化学方程式为NCl3+4H2O=NH3H2O+3HClO,请设计实验证明该水解反应的产物______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷分子结构的说法正确的是( )
A.CH4有还原性,可使酸性高锰酸钾溶液褪色
B.甲烷的电子式为![]() ,分子中各原子都达到“8电子”稳定结构
,分子中各原子都达到“8电子”稳定结构
C.CH3Cl只有一种结构,说明甲烷是以碳原子为中心的正四面体结构
D.做CH4与Cl2发生取代反应实验时,应将反应装置放在光亮的地方
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大。A、E同主族,E原子最外层上的电子数是D原子最外层电子数的4倍,D离子与C2-具有相同核外电子排布。
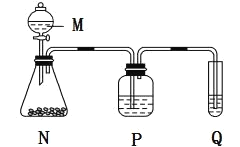
试回答下列问题:
(1)元素E在元素周期表中的位置是______。
(2)A和E最高价氧化物对应的水化物,酸性较弱的为_____。若用图中装置验证这两种酸的酸性强弱,则在仪器P中加入的试剂为_____,Q中观察到的实验现象是_____。
(3)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有_____。
②b与c反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiOOH难溶于水,常作电池的正极材料。利用某含镍废料(主要成分为NiO,另含有SiO2、Fe2O3、CuO三种杂质)制备NiOOH的工业流程如图。
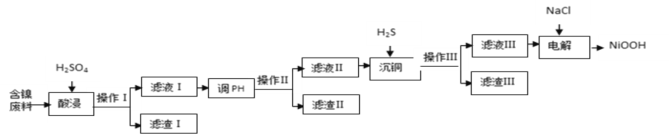
已知:
Fe(OH)3 | Cu(OH)2 | Ni(OH)2 | |
开始沉淀的pH | 1.5 | 4.4 | 6.7 |
沉淀完全的pH | 3.7 | 6.9 | 9.2 |
(1)提高酸浸速度的方法为_______________________、_____________________(任写2条)
(2)滤渣Ⅰ的成分为__________;若滤渣Ⅱ为Fe(OH)3,则“调pH”的范围为_____________.
(3)沉铜时发生反应的离子方程式为______________________________________________。
(4)电解过程是控制在碱性条件下阳极产生ClO-,并用ClO-将Ni2+氧化的过程。请写出氧化过程中发生反应的离子方程式____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
Fe3O4(s)+4H2(g),下列条件的改变对反应速率几乎无影响的是
A. 把铁块换成铁粉 B. 将容器的体积压缩至原体积的一半
C. 压强不变,充入氮气使容器体积增大 D. 体积不变,充入氮气使容器压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com