
【题目】通过对酸、碱、盐知识的学习,我们已经知道固体氢氧化钠可以作为某些气体的干燥剂,下列潮湿的气体不能用固体氢氧化钠干燥的 ( )
A.H2B.CO2C.COD.O2
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物的顺序排序正确的是( )
A. 稀有气体、尿素、冰水混合物 B. 乙醇、浓硫酸、胆矾
C. 金刚石、铁矿石、大理石 D. 水银、水蒸气、水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)此反应的热化学方程式为________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
气态肼和二氧化氮反应的热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂即可鉴别出来,鉴别的先后顺序是( )
A. ③④②① B. ③④①②
C. ②①③④ D. ④③①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NO、CO2、N2O4三种气体,它们分别都含有0.5 mol氧原子,则三种气体的物质的量之比为( )
A. 1:2:4 B. 1:1:1 C. 4:2:1 D. 1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述一定正确的是( ) 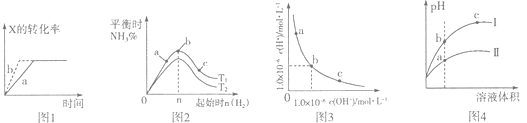
A.图l所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大
B.图2表示合成氨反应,温度T1和T2对应的平衡常数为K1、K2 , 则:T1<T2 , K1>K2
C.图3表明,该温度下,加入FeCl3不可能引起由b向a的变化
D.图4所示,用水稀释pH相同的盐酸和醋酸,I表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲对含少量硫酸亚铁和硫酸铁的硫酸铜溶液进行综合实验:
(1)除去Fe2+和Fe3+并制备CuSO45H2O,请根据以下流程回答问题:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 6.5 | 4.7 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 |
①试剂X的化学式为 , 加入试剂Y调节溶液pH的范围是;
②操作a用到的玻璃仪器为烧杯,玻璃棒和;操作b的名称为;
(2)已知:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01molL﹣1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是(填字母序号,夹持部分已略去)
达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其是否正确.下列几种类推结论中正确的是( )
A.由2Cu+O2 ![]() 2CuO可推出同族的硫也有Cu+S
2CuO可推出同族的硫也有Cu+S ![]() CuS
CuS
B.Fe3O4可表示为FeO?Fe2O3 , 则Pb3O4可表示为PbO?Pb2O3
C.Na能与水反应生成H2 , K、Ca也能与水反应生成H2
D.CO2与Na2O2反应只生成Na2CO3和O2 , 故SO2与Na2O2反应只生成Na2SO3和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定为2L的密闭容器中,发生反应:aA(g)+bB(g)pC(g)△H=?,反应情况记录如表:
时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
0 | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=molL﹣1min﹣1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、6min时分别改变了某一个反应条件,则改变的条件分别可能是:①第 2min;②第 6min;
(3)反应在第4min建立平衡,此温度下该反应的化学平衡常数 K= .
(4)判断第9min时(是/否)达平衡,说明理由 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com