
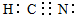
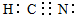
 CH3COOH+OH-
CH3COOH+OH- CH3COOH+OH-
CH3COOH+OH-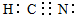 ,D、E形成的离子化合物中阴阳离子个数比为1:2,化合物可能为Na2O2或Na2O,如为Na2O2,O2-中存在共价键;如为Na2O,则不存在共价键,
,D、E形成的离子化合物中阴阳离子个数比为1:2,化合物可能为Na2O2或Na2O,如为Na2O2,O2-中存在共价键;如为Na2O,则不存在共价键,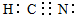 ;不一定存在共价键,如为Na2O2,O2-中存在共价键;如为Na2O,则不存在共价键;
;不一定存在共价键,如为Na2O2,O2-中存在共价键;如为Na2O,则不存在共价键; CH3COOH+OH-,
CH3COOH+OH-, CH3COOH+OH-;
CH3COOH+OH-;

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
 (2012?株洲一模)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu( NO3)2、HN03物质的量浓度之比为( )
(2012?株洲一模)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度与加入铁粉的物质的量之间的关系如图所示.则溶液中Fe(NO3)3、Cu( NO3)2、HN03物质的量浓度之比为( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com