
分析 (1)热化学方程式要标明物质的聚集状态,并且焓变的符号和单位要正确,依据热化学方程式和盖斯定律含义计算,将方程式CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=260kJ•mol-1①;2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,2×①+②得CH4与O2反应生成CO和H2的热化学方程式;
(2)水电离的C(H+)=C(OH-),离子积为4×10-14,温度不变,Kw不变.
解答 解:(1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1①;
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2×①+②得:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1;
(2)纯水中c(H+)=2×10-7 mol•L-1,水电离的c(H+)=c(OH-),离子积为4×10-14>1×10-14,水的离子积常数随着温度升高升高,所以温度大于25°C,滴入稀盐酸使C(H+)=8×10-4 mol/L,则此时溶液中的c(OH-)=水电离的c(H+)=$\frac{4×1{0}^{-14}}{8×1{0}^{-4}}$=5×10-11mol/L,故答案为:>;5×10-11 mol/L.
点评 本题考查学生盖斯定律的应用、反应热的计算以及水的离子积常数的影响因素和计算等知识,属于综合知识的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | f.g.k.m | B. | c.j.k.m | C. | c.h.i.k | D. | f.g.h.j. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 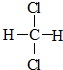 和 和  | B. | CH2=CH-CH=CH2和  | ||
| C. | 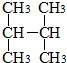 和 和 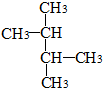 | D. | C(CH3)3C(CH3)3和CH3(CH2)3C(CH3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molAlCl3在熔融状态时离子总数为0.4NA | |
| B. | 2.2 g分子式为 2H218O的水中含有的中子数为1.2 NA | |
| C. | 电解饱和食盐水时,当阴极产生H2 22.4L时,电路中转移的电子数为2NA | |
| D. | 常温下pH=1的H2SO4溶液中,H+的浓度为0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,Cl2的摩尔质量为71g | |
| B. | 氧化还原反应一定有氧元素参加 | |
| C. | 标准状况下,1 mol CCl4的体积是22.4L | |
| D. | Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
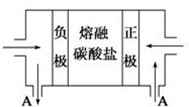 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaCO | NaCN |
| pH | 8.8 | 9.7 | .6 | 0.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 某元素从化合态变为游离态时,该元素一定被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com