
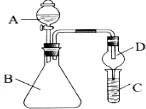
 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律分析 (1)根据仪器的构造以及常见仪器的名称分析,该仪器名称是分液漏斗;球形干燥管具有防止倒吸的作用;
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,浓盐酸和酸性高锰酸钾溶液反应生成氯气,氯气能氧化碘离子生成碘,碘遇淀粉试液变蓝色;氯气有毒,不能直接排空,能和水反应生成酸,可以用碱液处理尾气;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,在A中加盐酸,B中加CaCO3,制取二氧化碳,二氧化碳和硅酸钠反应生成硅酸,证明非金属性:C>Si.
解答 解:(1)仪器A具有球形特征的漏斗且带有玻璃活塞,该仪器名称是分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,
故答案为:分液漏斗;防倒吸;
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,浓盐酸和酸性高锰酸钾溶液反应生成氯气,2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,所以B中加高锰酸钾,也可用氯酸钾、次氯酸盐,氯气能氧化碘离子生成碘Cl2+2I-=I2+2Cl-,碘遇淀粉变蓝,验证非金属性Cl>I,所以看到的现象是溶液变蓝色;氯气有毒,不能直接排空,能和水反应生成酸,可以用碱液NaOH处理尾气,所以此装置的不足之处是缺少尾气处理装置,
故答案为:高锰酸钾、氯酸钾、次氯酸盐均可;变蓝;缺少尾气处理装置;
(3)在A中加盐酸,B中加CaCO3,根据强酸制弱酸原理,碳酸钙与盐酸反应生成二氧化碳:CaCO3+2HCl═CaCl2+CO2↑+H2O,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,若要证明非金属性:C>Si,C中需放硅的最高价氧化物对应的酸硅酸的盐,所以C中放硅酸钠,在C中通入二氧化碳气体生成硅酸沉淀,反应的方程式为CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,说明碳酸酸性比硅酸强,从而说明非金属性:C>Si,因为盐酸的挥发性导致生成的二氧化碳中含有盐酸,盐酸和硅酸钠反应干扰二氧化碳的检验,应该用饱和碳酸氢钠溶液除去盐酸,
故答案为:NaSiO3溶液; 饱和NaHCO3溶液.
点评 本题考查验证同主族元素非金属性的变化规律实验方案设计,为高频考点,侧重考查学生实验操作、物质性质、元素周期律等知识点,明确实验原理及物质性质是解本题关键,注意各个仪器的用途,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题



 ,反应类型为加成反应.
,反应类型为加成反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).
据报道,在西藏冻土的一定深度下,发现了储量巨大的“可燃冰”,它主要是甲烷和水形成的水合物(CH4•nH2O).| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g Na 与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 23gNO2和N2O4混合气体中含有原子总数为1.5NA | |
| C. | 足量Cu和100mL18mol/L热浓硫酸反应可生成0.9 NA个SO2分子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
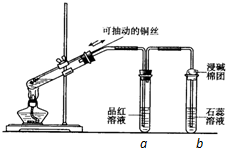 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com