
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯的化学性质比乙烷活泼 | |
| D. | 乙烯和环丙烷(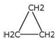 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
分析 A.乙烯分子中含有C=C双键,其中1个C-C容易断裂;
B.依据乙烯分子空间结构解答;
C.乙烯分子中含有C=C双键,其中1个C-C容易断裂;
D.结构相似、组成上相差1个或多个CH2原子团的同类物质互称为同系物.
解答 解:A.乙烯分子中含有C=C双键,其中1个C-C容易断裂,化学性质活泼,容易发生加成反应和氧化反应,故A正确;
B.乙烯分子是平面结构,所有原子都在同一个平面上,且碳氢键之间的键角约为120°,故B正确;
C.乙烯分子中含有C=C双键,其中1个C-C容易断裂,化学性质比乙烷活泼,容易发生加成氧化反应,故C正确;
D.乙烯与环丙烷结构不相似,不是同类物质,不属于同系物,故D错误.
故选D.
点评 本题考查了乙烯结构与性质及同系物概念,明确乙烯分子的空气结构及成键特点、熟悉同系物概念是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
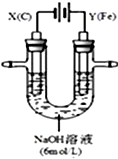 某课外小组分别用如图所示装置对电解原理进行实验探究.
某课外小组分别用如图所示装置对电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该铜铂电池属于二次电池 | |
| B. | 电子移动方向与纳米发动机移动方向相同 | |
| C. | 铜为铜柏电池的正极 | |
| D. | 铂极发生的电极反应为HBrO+H++2e-=Br-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | |
| D. | 油酸和水,甲苯和水,己烷和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 金属和非金属化合时一定形成离子键 | |
| D. | 含有共价键的化合物都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物的最简式为 CH3O | B. | 该有机物的分子式可能为 CH3O | ||
| C. | 该有机物的分子式可能为 C2H6O | D. | 该有机物1H核磁共振谱中有两个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
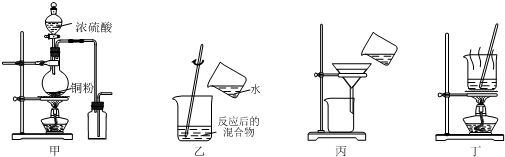
| A. | 用图甲装置制取并收集二氧化硫 | |
| B. | 用图乙装置向反应后的混合物中加水稀释 | |
| C. | 用图丙装置过滤出稀释后混合物中的不溶物 | |
| D. | 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
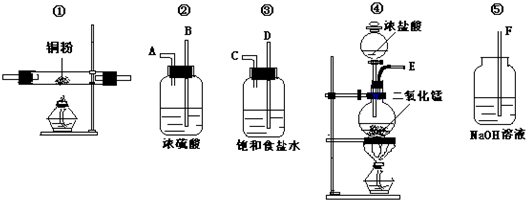
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com