
| A. | P4和NO2都是共价化合物 | |
| B. | CCl4和NH3都是以极性键结合的极性分子 | |
| C. | H2O2的分子是含有极性键的非极性分子 | |
| D. | 在SiC和SiO2晶体中,都不存在单个小分子 |
分析 A.P4为单质;
B.CCl4的结构对称,正负电荷的中心重合;
C.H2O2的分子结构中正负电荷中心不重合,不是非极性分子;
D.SiC和SiO2晶体属于原子晶体,不存在单个分子.
解答 解:A.P4为单质,NO2是共价化合物,故A错误;
B.CCl4的结构对称,正负电荷的中心重合为非极性分子,NH3是以极性键结合的极性分子,故B错误;
C.H2O2的分子结构中正负电荷中心不重合,不是非极性分子,故C错误;
D.SiC和SiO2晶体属于原子晶体,不存在单个分子,故D正确.
故选:D.
点评 本题为小综合,涉及物质的分类、分子的极性和键的极性、晶体类型及构成微粒,注重基础知识的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | b、c与a形成化合物的稳定性一定为b>c | |
| B. | a和d形成的化合物与水反应产生气体可以作燃料 | |
| C. | c,a和b可形成的化合物为离子化合物 | |
| D. | a、b、c、d四种元素组成的化合物的水溶液可以为酸性、也可以为碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的熔、沸点逐渐降低 | B. | 卤素单质的熔、沸点逐渐降低 | ||
| C. | 碱金属单质的密度逐渐增大 | D. | 卤素单质的密度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||||||||||||
| D | E | I | |||||||||||||||
| B | C | F | H | G | |||||||||||||
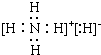 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物一定不是共价化合 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用滴管滴加液体时,滴管应垂悬在容器上方,不能触及容器内壁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
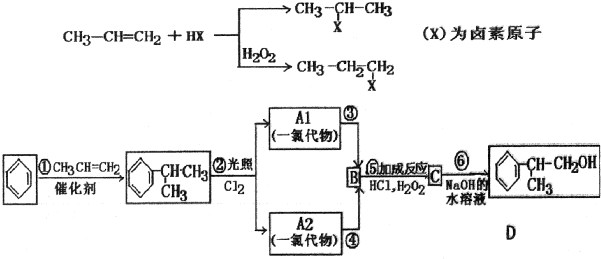
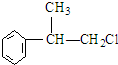 、,
、,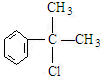 ;
; ,C的结构简式:
,C的结构简式: ;
; +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl;
+NaCl;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁设备与直流电源正极相连可防腐 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可以用于饮用水的杀菌消毒 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫不能用勒夏特列原理解释 | |
| D. | 废旧电池中的汞、锅、铅等重金属盐对土壤和水源会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应一定只伴随热量的变化 | |
| B. | 凡是吸热或放热过程中热量的变化均称为反应热 | |
| C. | 若△H<0,则反应物的能量高于生成物的能量 | |
| D. | 若△H>0,则反应物的能量高于生成物的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com