
【题目】人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g)![]() HbO2(aq) H1<0;
HbO2(aq) H1<0;
反应②:Hb(aq)+CO(g)![]() HbCO(aq) H2<0
HbCO(aq) H2<0
反应③:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3
HbCO(aq)+O2(g) H3
(1)H3=_____(用H1、H2表示);反应③自发进行的趋势较大,则H1_____H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________。
②该反应平衡总数的表达式为![]() ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______,a(Mb)=________(用含p(O2)的式子表示)。

③ T℃时,![]() kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
kPa-1,则T______37(填“>”、“<”或“=”),理由是________________。
【答案】H2-H1 > 增大O2的浓度,减小CO的浓度,使平衡逆移 80.0kPa 2 kPa-1 2 kPa-1 ![]() >
> ![]() ,K(T℃)<K(37℃),该反应为放热反应,升温会使平衡常数减小
,K(T℃)<K(37℃),该反应为放热反应,升温会使平衡常数减小
【解析】
(1)根据盖斯定律,将②-①,整理可得③式;根据体系的自由能G=H-TS<0,反应能够自发进行判断;
(2)O2是生成物,增大生成物O2的浓度,可以使平衡逆向移动,也可以对CO进行稀释;
(3)①根据速率要求,结合速率常数只与温度有关分析;
②根据平衡常数的含义,结合37℃时,O2的平衡分压为20.0kPa,用三段式计算;
③结合正、逆反应速率的公式及可逆反应达到平衡时二者相等,再根据温度与反应热的关系判断。
(1)由于化学反应中的能量变化与反应途径无关,只与物质的始态和中态有关,根据盖斯定律,将②-①,整理可得③式,热化学方程式为:HbO2(aq)+CO(g)![]() HbCO(aq)+O2(g) H3=H2-H1;反应③自发进行的趋势较大,说明体系的自由能G=H-TS<0,该反应反应前后气体体积不变,则说明H3<0,由于H3=H2-H1;则H1>H2;
HbCO(aq)+O2(g) H3=H2-H1;反应③自发进行的趋势较大,说明体系的自由能G=H-TS<0,该反应反应前后气体体积不变,则说明H3<0,由于H3=H2-H1;则H1>H2;
(2)O2是生成物,增大生成物的浓度,平衡逆向移动,可以使血红蛋白与CO解离,就可以减轻人体的中毒症状;
(3)①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,由于v正=kAc(Mb)p(O2),则速率为正常人的四倍,则氧气产生的压强也为原来的四倍,因此解毒时提供病人呼吸的O2的压强是4×20.0kPa=80.0kPa;
②假设开始时Mb的浓度为1,根据三段式
可逆反应 Mb(aq)+O2(g)![]() MbO2(aq)
MbO2(aq)
c(开始) 1 0
c(转化) a a
c(平衡) 1-a a
K=![]() ,根据空气中p(O2)为20.0kPa,此时a=80%,带入上式可得K=
,根据空气中p(O2)为20.0kPa,此时a=80%,带入上式可得K=![]() =2.0(kPa)-1;
=2.0(kPa)-1;
假设开始时Mb的浓度为1,根据三段式
可逆反应 Mb(aq)+O2(g)![]() MbO2(aq)
MbO2(aq)
c(开始) 1 0 0
c(转化) a p(O2) a
c(平衡) 1-a p(O2) a
K=![]() ,整理可a=
,整理可a=![]() ,由于该温度下平衡常数K=2,将K=2带入上式可得a=
,由于该温度下平衡常数K=2,将K=2带入上式可得a=![]() 。
。
③肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g) ![]() MbO2(aq) ,H<0,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)当反应达到平衡时,v正= v逆,kAc(Mb)p(O2)= kDc(MbO2),则
MbO2(aq) ,H<0,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)当反应达到平衡时,v正= v逆,kAc(Mb)p(O2)= kDc(MbO2),则![]() ,在37℃时K=2.0(kPa)-1>-1(kPa)-1,说明平衡逆向移动,由于该反应的正反应为放热反应,根据平衡移动原理,升高温度,平衡向吸热的逆反应方向移动,使化学平衡常数降低,所以温度T>37℃。
,在37℃时K=2.0(kPa)-1>-1(kPa)-1,说明平衡逆向移动,由于该反应的正反应为放热反应,根据平衡移动原理,升高温度,平衡向吸热的逆反应方向移动,使化学平衡常数降低,所以温度T>37℃。


科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是
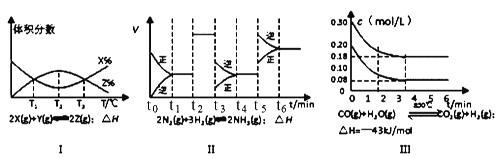
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时,NH3体积分数最大
C. 由图Ⅱ知,t3时采取的措施是降低反应体系温度
D. Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸酐(顺-丁烯二酸酐)![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:①![]()
②
③![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
回答下列问题:
(1)C的名称是________,反应②的反应类型是___________。
(2)B的顺式结构简式为_________,F的结构简式为__________。
(3)反应①的化学方程式为_________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为______(不考虑立体异构)。
(5)已知:氨基(-NH2)与羟基类似,也能发生反应①。在由F制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为______。
(6)已知:酸酐在水溶液中极易水解。写出由马来酸酐![]() 合成酒石酸
合成酒石酸![]() 的合成路线:____________________。
的合成路线:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是

A. Cu+H2SO4= CuSO4+H2↑这个反应可设计成原电池。
B. 利用Cu+2FeCl3=CuCl2+2FeCl2,可设计如图所示原电池装置,盐桥内K+向FeCl3溶液移动。
C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,铁作负极,铜作正极,其负极反应式为Fe-2e-=Fe2+。
D. 由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+2OH-=Mg(OH)2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. HClO电离 HClO=ClO-+H+
B. CuSO4水解 Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
C. NaHCO3电离 NaHCO3![]() Na++HCO3-
Na++HCO3-
D. KF水解 Fˉ+H2O![]() HF+OHˉ
HF+OHˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是

A. 二者物质的量之比为3∶2
B. 二者质量之比为3∶2
C. 二者摩尔质量之比为2∶3
D. 二者消耗H2SO4的物质的量之比为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 煤中含有苯、甲苯和粗氨水,可通过干馏得到
B. C4H8Cl2的同分异构体有7种
C. 甲苯和乙苯分子内共平面的碳原子数最多均为7
D. 由乙醇和乙酸生成乙酸之酯属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2![]() PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高磷鲕状赤铁矿(主要含有![]() 、少量
、少量![]() 、CaO,
、CaO,![]() 等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
等)是我国一种重要的沉积型铁矿资源,以高磷鲕状赤铁矿为原料制备纯度较高的铁红,其流程如图所示。下列说法错误的是
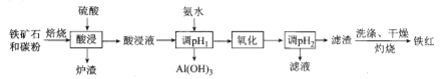
A. 铁红可用于油漆、油墨、建筑物着色剂
B. 酸浸液遇![]() 溶液生成蓝色沉淀
溶液生成蓝色沉淀
C. 洗涤滤渣时要用玻璃棒不断搅拌
D. 氧化时选用的试剂可以是![]() 、NaClO溶液
、NaClO溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com