
| A. | 72.4% | B. | 77.8% | C. | 70% | D. | 30% |
分析 铁不与氢氧化钠溶液反应,则把ag铁、铝粉末混合物溶于足量NaOH溶液后过滤出的沉淀为Fe,Fe与水蒸气在高温下反应生成固体为Fe3O4;再根据充分反应后得到Fe3O4的质量仍为ag可知原混合物中Al的质量与Fe3O4中O元素的质量相等,所以原混合物中Fe的质量分数=Fe3O4中Fe的质量分数,据此进行计算.
解答 解:铁不与氢氧化钠溶液反应,则把ag铁、铝粉末混合物溶于足量NaOH溶液后过滤出的沉淀为Fe,Fe与水蒸气在高温下反应生成固体为Fe3O4,
由于充分反应后得到Fe3O4的质量仍为ag,则原混合物中Al的质量与Fe3O4中O元素的质量相等,
即:原混合物中Fe的质量分数=Fe3O4中Fe的质量分数,
所以原混合物中铁的质量分数为:$\frac{56×3}{56×3+16×4}$×100%≈72.4%,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,试题侧重考查学生得到分析、理解能力及灵活应用能力.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有大量Fe3+的溶液:Na+、SCN-、Cl-、I- | |
| B. | 中性溶液:Fe3+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 常温下,pH=12的溶液:Na+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 与铝粉反应放出H2的无色溶液:Br-、Al3+、Na+、SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3A+2B=2C | B. | 2A+3B=2C | C. | 3A+2B=3C | D. | A+B=C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
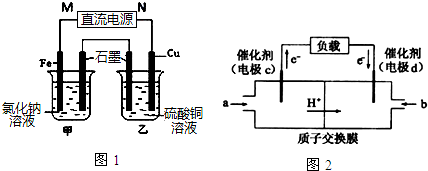
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
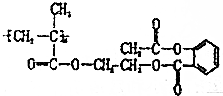 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )| A. | 2.19n g | B. | 2.19g | C. | $\frac{2.92}{n}$g | D. | 2.92g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
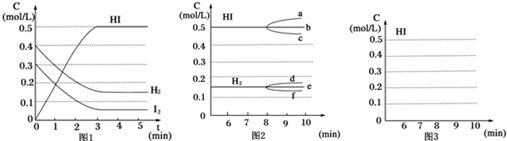
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量 变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 0 | 0 | 2 | 吸收热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | 热量关系:a+b=92.4 | B. | 三个容器内反应的平衡常数:③>①=② | ||
| C. | 平衡时氨气的体积分数:①=②>③ | D. | ①N2的转化率+②NH3的转化率=100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3(加MnO2催化剂,加热) | B. | KMnO4(加热) | ||
| C. | H2O2(水溶液,加MnO2催化剂) | D. | HgO(加热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com