
(Ⅰ)化学平衡移动原理,同样也适用于其他平衡
(1)已知在氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O
 NH+OH-
NH+OH-
向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度
向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象是___________。
(2)氯化铁水解的离子方程式为___________________,向氯
化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其离子方程
式为________________,同时有红褐色沉淀生成,其原因是
_ ___________________________________________________________。
(3)向Mg(OH)2的悬浊液中加入NH4Cl溶液,现象 ,原
因为
。
(Ⅱ)某二元酸 H2A 的电离方程式是:H2A=H++HA,HA- A2-+H+。回答下列问题:
A2-+H+。回答下列问题:
(1)H2A是 (填“强电解质”或“弱电解质”或“非电解质”)
(2)Na2A 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(3)NaHA 溶液显 (填“酸性”、“碱性”或“中性”),理由是(用离子方
程式表示) ;
(4)若 0.1mol·L-1NaHA 溶液的 pH=2,则 0.1mol·L-1 H2A溶液中氢离子的物质
的量浓度可能 0.11mol·L(填“<”、“>”或“=”),理由是: ;
(5)0.1mol·L NaHA溶液中各离子浓度由大到小的顺序是 。
(Ⅰ)(1)右 减小 左 有刺激性气体产生
(2)Fe3+ +
3H2O Fe(OH)3
+ 3H+ 、 CaCO3 + 2H+ === Ca2+ + H2O +CO2↑
Fe(OH)3
+ 3H+ 、 CaCO3 + 2H+ === Ca2+ + H2O +CO2↑
碳酸钙消耗H+ ,促进氯化铁的水解,使水解产物 Fe(OH)3大量生成,形成红褐色沉淀 [来源:]
(3)浊液逐渐溶解 溶液中存在平衡 Mg(OH)2
(S)  Mg2+ (aq)+2OH- (aq) ,加入NH4Cl溶液会发生OH- +NH4+=NH3·H2O ,导致平衡向溶解方向移动,故悬浊液逐渐溶解
Mg2+ (aq)+2OH- (aq) ,加入NH4Cl溶液会发生OH- +NH4+=NH3·H2O ,导致平衡向溶解方向移动,故悬浊液逐渐溶解
(Ⅱ)(1)强电解质
(2)碱性 A2-+H2O HA-+OH-
HA-+OH-
(3)酸性 HA- H++ A2-
H++ A2-
(4)< 因H2A第1步电离产生的H+抑制HA-的电离
(5)c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
【解析】


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:阅读理解
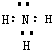
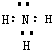
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-| 4 |
| 27 |
| 4 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)达到平衡时所需的时间A容器比B容器________,A容器中SOz的转化率比B容器中的________。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器中化学平衡移动________,B容器中化学平衡________移动。
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器中SO3的物质的量分数________;B容器中SO3的物质的量分数________。(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
(满分10分)有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等。在400℃条件下,发生如下反应:2SO2(g) + O2(g)2SO3(g)。
(1)达到平衡时,所需的时间t(A) t(B),A容器中SO2的转化率比B容器中 。(填“大、小或相等)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡 移动,B容器中化学平衡 移动。(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3) ,B容器中SO3的质量分数 。(填“增大、减少或不变”)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省深圳高级中学高二下学期期中化学试卷(带解析) 题型:填空题
(满分10分)有两个容积相等的密闭容器A和B(如图)所示,A容器有一个可上下移动的活塞,能使容器保持恒压,B容器的容积不变。起始时这两个容器中分别充入等量按体积比为2:1的SO2和O2的混合气体,并使A和B容积相等。在400℃条件下,发生如下反应:2SO2(g) + O2(g) 2SO3(g)。
2SO3(g)。
(1)达到平衡时,所需的时间t(A) t(B),A容器中SO2的转化率比B容器中 。(填“大、小或相等)
(2)达到(1)所述平衡后,若向两容器中通入少量的等量氩气,A容器中化学平衡 移动,B容器中化学平衡 移动。(填“向左、向右、不”)
(3)达到(1)所述平衡后,若向两容器中通入等量原反应气体,再达到平衡时,A容器中c(SO3) ,B容器中SO3的质量分数 。(填“增大、减少或不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com